Benzeengeschiedenis, structuur, eigenschappen, derivaten, gebruik

- 5068
- 165
- Ernesto McKenzie
Hij benzeen Het is een organische verbinding die bestaat uit een van de eenvoudigste aromatische koolwaterstoffen. De chemische formule is c6H6, waarvan het bekend is dat de relatie tussen koolstof en waterstof gelijk is aan 1; dat wil zeggen, voor elke koolstof is hier een waterstof gekoppeld.
Hoewel het fysieke uiterlijk van een kleurloze vloeistof is, wordt het natuurlijk aangetroffen in olie en producten die daarvan zijn afgeleid. De geur is erg kenmerkend, omdat het lijkt op een mengsel van lijm, bitumen en benzine; Aan de andere kant is het een vluchtige en brandbare vloeistof.
 Belfing met benzeen. Bron: air1404 [CC door 4.0 (https: // creativeCommons.Org/licenties/door/4.0)]
Belfing met benzeen. Bron: air1404 [CC door 4.0 (https: // creativeCommons.Org/licenties/door/4.0)] In het bovenste beeld wordt een container of fles met benzeen getoond, vermoedelijk van niet -analytische zuiverheid. Als benzeenampen onmiddellijk door het laboratorium worden ontdekt. Om deze reden wordt deze vloeistof, gewoonlijk gebruikt als een eenvoudig oplosmiddel, gemanipuleerd in een gas -extractorbel.
Je formule zijn c6H6, De negentiende -eeuwse chemicaliën hebben talloze mogelijke structuren verhoogd die overeenkomen met die aandeel C/H gelijk aan 1. Niet alleen dit, maar het benzeenmolecuul moest op een zodanige manier speciale links hebben dat de ongebruikelijke stabiliteit ervan kon worden verklaard aan de toevoegingsreacties; Typisch voor alkenen en beleid.
Het was zo dat zijn banden een enigma vertegenwoordigden voor de chemicaliën van die tijd; Tot het onroerend goed belde aromaticiteit. Voordat je wordt beschouwd als een hexacyclotrieen (met drie banden c = c), is benzeen veel meer dan dat, en het is een van de vele voorbeelden van synergie in chemie.
In de organische chemie is benzeen een klassiek symbool, structurele basis voor meerdere polylaromatische verbindingen. Uit zijn zeshoek worden symfines van derivaten verkregen via aromatische elektrofiele substitutie; Een ring waarvan de randen grenst aan de structuur die nieuwe verbindingen definieert.
In feite zijn de derivaten het enorme industriële gebruik verschuldigd voor degenen die benzeen nodig hebben onder hun grondstof. Van de bereiding van textiellijm en vezels, tot kunststoffen, rubbers, pigmenten, medicijnen en explosieven. Aan de andere kant wordt van nature benzeen gevonden in vulkanen, bosbranden, benzine en in de rook van de sigaretten.
[TOC]
Geschiedenis
Ontdekking en namen
Zijn ontdekking dateert uit 1825, normaal toegekend aan Michael Faraday, toen hij verzamelde en experimenten deed met een resterend olieproduct van het gas dat wordt gebruikt voor verlichting. Deze vloeistof bevatte een aandeel c/h dicht bij 1, daarom noemde het het 'carburated waterstof'.
De chemicus Auguste Laurent benoemde de vreemde koolwaterstof 'feno', afgeleid van het Griekse woord 'Phaínein'Wat betekent briljant (omdat het werd verkregen na het verbrande gas). Deze naam werd echter niet geaccepteerd door de wetenschappelijke gemeenschap en had alleen de overhand als 'fenyl', om te verwijzen naar de radicale afkomstig van benzeen.
Uit het benzoïne -rubber slaagde de chemicus Eilhard Mitscherlich, negen jaar later, erin om dezelfde verbinding te produceren; Er was daarom een andere bron voor dezelfde koolwaterstof, die hij doopte als 'benzina'. Ze beschouwden echter ook niet de juiste naam om aan te nemen dat het een alkaloïde was, zoals kinine.
Zo vervingen ze de naam 'Bencina' door 'Benzol'. Er waren echter weer tegenstrijdigheden en discrepanties omdat de term 'benzol' koolwaterstof verwardde voor een alcohol. Het was toen dat de naam 'benzeen' werd geboren, eerst werd gebruikt in Frankrijk en Engeland.
Het kan u van dienst zijn: lithiumcarbonaat (Li2CO3): structuur, eigenschappen, gebruikIndustriële productie
Verlichtingsgas noch benzoingom waren geschikte bronnen om benzeen op grote schalen te genereren. Charles Mansfield, samen met augustus Wilhelm von Hofmann, wordt in 1845 bereikt de benzeen (twintig jaar na de ontdekking) van het Hulla -teer, lateraal product van de cokesproductie.
Zo begon de industriële productie van benzeen vanaf de Hulla Tar. De beschikbaarheid van benzeen in massieve hoeveelheden, vergemakkelijkte de studie van zijn chemische eigenschappen en liet het toe om het te relateren aan andere verbindingen van vergelijkbare reactiviteiten. August Wilhelm von Hofmann bedacht het woord 'aromatisch' voor benzeen en gerelateerde verbindingen.
Historische structuren
August Kekulé's droom
Friedrich August Kekulé krijgt rond 1865 de zeshoekige en cyclische structuur van benzeen, voortkomend uit een vreemde droom met Uroboros, de slang die zijn eigen staart bijt door een cirkel te tekenen. Zo geloofde hij dat benzeen kon worden beschouwd als een zeshoekige ring, en andere chemicaliën verhoogden mogelijke structuren, die hieronder worden getoond:
 Benzeenringstructuren voorgesteld door de geschiedenis heen. Bron: Jü [Public Domain]
Benzeenringstructuren voorgesteld door de geschiedenis heen. Bron: Jü [Public Domain] Sommige bovenste structuren kunnen de stabiliteit van benzeen rechtvaardigen.
Boek, ringen en prisma
Merk op dat de derde structuur niet eens een ring is, maar een driehoekig prisma, voorgesteld door Albert Ladenburg in 1869; Links van hem, een open boekvormige, voorgesteld door Sir James Dewar in 1867; En aan zijn rechterkant, één met alle hydrogenen gericht op het midden van de ring, voorgesteld door Henry Edward Armstrong in 1887.
De eerste structuur, voorgesteld door Adolf Karl Ludwig Claus in 1867, is ook vrij bijzonder, omdat C-C-banden worden gekruist. En de laatste was Kekulé's "Serpentine" -ring, gedroomd in 1865.
Wat was de "winnaar"? De vijfde structuur (van links naar rechts), voorgesteld in 1899 door Johannes Thiele.
Hierin werd de resonantiehybride voor het eerst overwogen, die de twee Kekulé -structuren combineerde (de eerste ring aan de rechterkant om het te observeren) en buitengewoon de verplaatsing van de elektronen uitlegde en daarmee de tot dan toe ongebruikelijke stabiliteit van de benzeen.
Benzeenstructuur
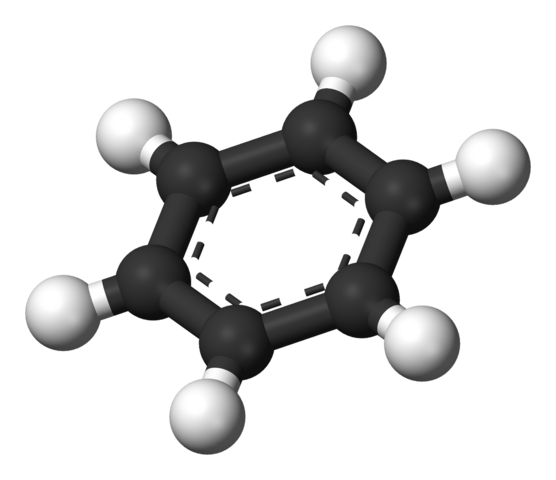 Benzeen aromatische ring. Bron: Benjah-bmm27 [Public Domain]
Benzeen aromatische ring. Bron: Benjah-bmm27 [Public Domain] De door Thiele voorgestelde structuur wordt weergegeven door een bollen en barsmodel.
Het benzeenmolecuul is plat, met de waterstofatomen die uit de zijkanten van de ring wijzen. Alle koolstofatomen hebben SP -hybridisatie2, Met een orbitaal P Beschikbaar om het aromatische systeem te vestigen waarin zes elektronen verhuizen.
Deze carbonos sp2 Ze zijn meer elektronegatief dan hydrogenen, en daarom verwijder de eerste elektronische dichtheid voor de laatste (cSP2δ--Hδ+)). Bijgevolg heeft het midden van de ring een grotere concentratie elektronen dan zijn zijden.
Meer precies, het aromatische systeem kan worden weergegeven als een wolk of elektronische kussen die door beide zijden van de zeshoekige ring worden verwijderd; en in het midden, door de zijkanten of randen, een elektronisch tekort dat wordt gevormd door hydrogenen met een positieve gedeeltelijke belasting.
Dankzij deze verdeling van elektrische ladingen kunnen benzeenmoleculen met elkaar interageren via dipool-dipolo-krachten; De atomen hδ+ Ze voelen aantrekkingskracht op het aromatische centrum van een aangrenzende ring (hieronder zal worden weergegeven).
Evenzo kunnen aromatische centra bovenop elkaar worden gestapeld om de inductie van instant dipolen te bevorderen.
Kan u van dienst zijn: alotropieResonantie
 Structuren en resonantie hybride van benzeen. Bron: Edgar181 van Wikipedia.
Structuren en resonantie hybride van benzeen. Bron: Edgar181 van Wikipedia. De twee Kekulé -structuren worden bovenaan de afbeelding getoond en onder hen de resonantie hybride. Aangezien de twee structuren steeds opnieuw plaatsvinden, wordt de hybride weergegeven met een cirkel in het midden (vergelijkbaar met die van een "zeshoekige donut").
De hybride cirkel is belangrijk omdat het het aromatische karakter van benzeen aangeeft (en dat van vele andere verbindingen). Bovendien wijst hij erop dat de links niet zo lang zijn als C-C, noch zo kort als C = C; Maar hun lengte is tussen beide uiteinden. Benzeen wordt dus niet als een polyheen beschouwd.
Het bovenstaande is aangetoond door de meting van de lengtes van de C-C-banden (139 pm) van de benzeen, die een beetje meer langwerpig zijn dan de C-H-bindingen (109 pm).
Kristallen
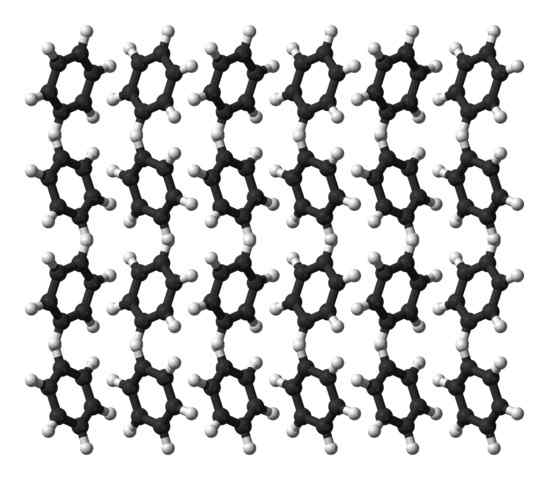 Benzeen ortorrombische kristalstructuur. Bron: Ben Mills [Public Domain]
Benzeen ortorrombische kristalstructuur. Bron: Ben Mills [Public Domain] Benzeen is een vloeistof bij kamertemperatuur. De intermoleculaire krachten maken, ondanks dat het een dergelijk dipoolmoment heeft uitgesproken, kan het zijn moleculen bij elkaar houden in een vloeistof die kookt op 80 ° C. Wanneer de temperatuur onder 5 ° C daalt, begint het benzeen te bevriezen: en dus worden hun overeenkomstige kristallen verkregen.
Benzeenringen kunnen structurele patronen aannemen die in hun vaste stof zijn gedefinieerd. Hun dipolen maken ze "gekanteld" naar links of rechts, waardoor rangen kunnen reproduceren door een ordeer ortorrombische cel. Benzeenkristallen zijn dus ortorrombisch.
Let op in het superieure beeld dat wanneer de ringen geneigd zijn om de interacties tussen de H te bevorderenδ+ en de aromatische centra, genoemd in eerdere subsecties.
Eigenschappen
Moleculaire massa
78,114 g/mol.
Fysiek uiterlijk
Kleurloze vloeistof met een geur vergelijkbaar met benzine.
Kookpunt
80ºC.
Smeltpunt
5.5ºC.
ontstekingspunt
-11ºC (gesloten beker).
Zelf -uitsluittemperatuur
497.78ºC.
Dikte
0.8765 g/ml bij 20 ° C.
Oplosbaarheid
Een liter kokend water kan nauwelijks 3,94 g benzeen oplossen. Zijn apolaire personage maakt het praktisch niet -mengbaar met water. Het is echter mengbaar met andere oplosmiddelen, zoals ethanol, ethers, aceton, oliën, chloroform, koolstoftetrachloride, enz.
Dampdichtheid
2.8 in de luchtrelatie (dat wil zeggen bijna drie keer meer).
Dampdruk
94,8 mm Hg bij 25 ° C.
Verbranding warmte
-3267,6 kJ/mol (voor vloeibare benzeen).
Verdampingswarmte
33.83 kJ/mol.
Oppervlaktespanning
28.22 mn/m A 25ºC.
Brekingsindex
1.5011 tot 20ºC.
Derivaten

Benzeen -hydrogenen kunnen worden vervangen door andere groepen of atomen. Er kunnen een of meer vervangingen zijn, waardoor de mate van substitutie wordt verhoogd tot van de zes oorspronkelijke hydrogenen.
Bijvoorbeeld, Benceno als een pH-H, waarbij h een van de zes hydrogenen is. Herinnerend dat het midden van de ring een grotere elektronische dichtheid heeft, trekt elektrofielen aan, die de ring aanvallen om H te vervangen in een reactie genaamd aromatische elektrofiele substitutie (Sear).
Als deze H wordt vervangen door een OH, de ph-oh, zal fenol zijn; Een cho vervangen3, Ph-ch3, Tolueen; Als het NH is2, Ph-nh2, aniline; Of als het de cho is2Ch3, Ph-ch2Ch3, Ethylbenzeen.
Derivaten kunnen hetzelfde of giftiger zijn dan benzeen, of integendeel, zo complex worden dat ze een wenselijk farmacologisch effect worden.
Kan u van dienst zijn: calciumcarbide (CAC2): structuur, eigenschappen, verkrijgen, gebruikToepassingen
Het is een goed oplosmiddel voor een breed scala aan verbindingen, bijvoorbeeld aanwezig in schilderijen, vernissen, lijmen en coatings.
Het kan ook oliën, vetten of wassen oplossen, dus het is gebruikt als een essentie -extractor -oplosmiddel. Deze eigenschap werd in 1903 door Ludwig Roselius gebruikt om de koffie te cafepen, een operatie die al in onbruik is vanwege de toxiciteit van de benzeen. Evenzo werd het in het verleden gebruikt om metalen af te leggen.
In een van zijn klassieke toepassingen werkt het niet als een oplosmiddel, maar als een additief: verhoog het octaan van benzine, ter vervanging van de lead voor dit doel.
Benzeenderivaten kunnen verschillende toepassingen hebben; Sommigen dienen als pesticiden, smeermiddelen, wasmiddelen, kunststoffen, explosieven, parfums, kleurstoffen, lijm, medicijnen, enz. Als er in zijn structuur een benzenische ring is, is het vrij waarschijnlijk dat de synthese de benzeen heeft verlaten.
Een van de belangrijkste derivaten zijn: Cumeno, xyleen, aniline, fenol (voor de synthese van fenolharsen), benzoëzuur (conserveermiddel), cyclohexan (voor de synthese van de nilon), nitrobenzeen, resorcinol en ethylbenzezeen.
Nomenclatuur
De nomenclatuur van benzeenderivaten varieert afhankelijk van de mate van substitutie, wat zijn de substituentgroepen en hun relatieve posities. Benzeen kan dus lijden aan aap, di, tri, tetra, enz., Vervangingen
Wanneer de twee groepen zijn gekoppeld aan aangrenzende koolstofatomen, wordt de 'ortho' -denominatie gebruikt; Als er een koolstof is tussen het scheiden, 'doel'; En als koolstofatomen zich in tegengestelde posities bevinden, 'voor'.
In de lagere afbeeldingen worden voorbeelden van benzeenderivaten met hun respectieve namen die door de IUPAC worden bestuurd, getoond. Ze worden ook vergezeld door gemeenschappelijke of traditionele namen.
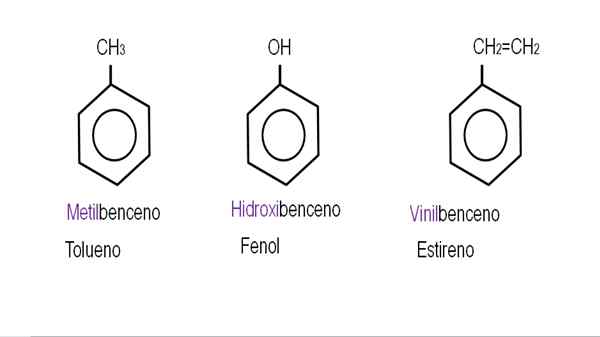 Monoderivated benzeen. Bron: Gabriel Bolívar.
Monoderivated benzeen. Bron: Gabriel Bolívar. 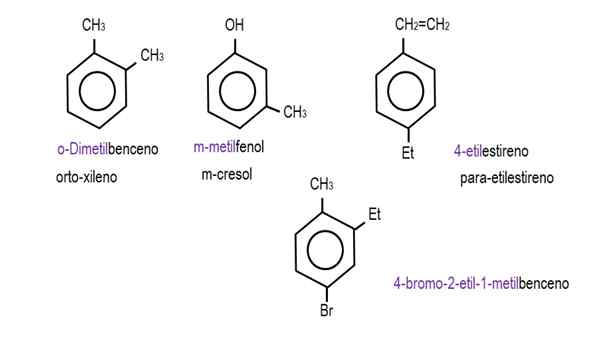 Andere benzeenderivaten. Bron: Gabriel Bolívar.
Andere benzeenderivaten. Bron: Gabriel Bolívar. Merk op dat in de trisustuated benzeen de ortho -indicatoren, voor en doel ze niet langer nuttig zijn.
Toxiciteit
Benzeen is een verbinding die zorgvuldig moet worden gemanipuleerd. Gezien de specifieke geur kunnen de onmiddellijke negatieve effecten verstikken, duizeligheid, hoofdpijn, trillingen, slaperigheid, misselijkheid en zelfs de dood zijn (vóór een hoge blootstelling). Als, naast wat al is genoemd, maagpijnen en aanvallen acuut kunnen veroorzaken.
Bovendien zijn langetermijneffecten onder constante blootstelling aan deze vloeistof carcinogeen; Verhoogt de kansen dat het individu lijdt aan een soort kanker, vooral bloed: leukemie.
In het bloed kan het de concentratie van rode bloedcellen verminderen, waardoor anemie wordt veroorzaakt en ook het beenmerg en de lever beïnvloedt, waar het door het lichaam wordt geassimileerd om nog meer toxische benzeenderivaten te genereren; Bijvoorbeeld hydroxiquinon. Het accumuleert ook in de nieren, het hart, de longen en de hersenen.
Referenties
- Morrison, r.T. En Boyd, r. N. (1987). Organische chemie. (5e editie). Addison-Wesley IberoAmericana.
- Carey, f. NAAR. (2008). Organische chemie. (6e editie). McGraw-Hill, Intermerica, Editores S.NAAR.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.
- Nationaal centrum voor biotechnologie -informatie. (2019). Benzeen. PubChem -database. CID = 241, hersteld van: PubChem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Benzeen. Opgehaald uit: in.Wikipedia.borg
- Garcia Nissa. (2019). Wat is benzeen? - Gebruik, structuur en formule. Studie. Hersteld van: studie.com
- Centrum voor ziektecontrole en Preventie. (4 april 2018). Feiten over benzeen. Hersteld van: noodsituatie.CDC.Gov
- Wereldgezondheidsorganisatie. (2010). Blootstelling aan benzeen: een grote zorgen over de volksgezondheid. [PDF]. Hersteld van: wie.inteken
- Fernández Germán. (S.F.)). Benzeen -nomenclatuurproblemen. Organische chemie. Hersteld van: chemicicaorganica.borg
- « Cosmopolitism Concept, Origins, Vision of Kant, Society
- Studieobject van toeristen geografie, oorsprong, hulpwetenschappen »

