Bromotimol blauw

- 3730
- 439
- Irving McClure I
 Bromotimol Blue is een pH -indicator. Bron: Wikimedia Commons
Bromotimol Blue is een pH -indicator. Bron: Wikimedia Commons Wat is bromotimol blauw?
Hij Bromotimol blauw Het is een afgeleide van trifenylmetano die dient als een pH -indicator. Een indicator is een organische kleurstof waarvan de kleur afhankelijk is van de concentratie van de ion h3OF+ of van de middelgrote pH. Vanwege de kleur die het vertoont, kan de indicator de zuurgraad of alkaliteit van de oplossing aangeven.
Bromotimol Blue heeft een actieve indicatieschaal tussen een pH 6.0 en 7.6. Tot een pH van het medium minder dan 6.5 (zuur) manifesteert een gele kleuring. Wanneer de middelgrote pH tussen 6 varieert.5 en 7.6 (neutraal), verwerft een groene kleuring. Een pH groter dan 7.6 De kleur is blauw (basic).
Deze functie geeft het een geweldig hulpprogramma, omdat het kan worden gebruikt op een pH -schaal dicht bij neutraliteit, precies waar er fysiologische processen optreden.
Bromotimol blauwe ionisatie in waterige oplossing kan als volgt worden gepresteerd:
Hin (geel) +h₂o in- (blauwe kleur) + h3OF+
Wanneer de indicator wordt geprotoneerd (HIN) verwerft een gele kleuring; Terwijl de indicator onbeschermd is (in-) Kleuren is blauw.
Chemische structuur
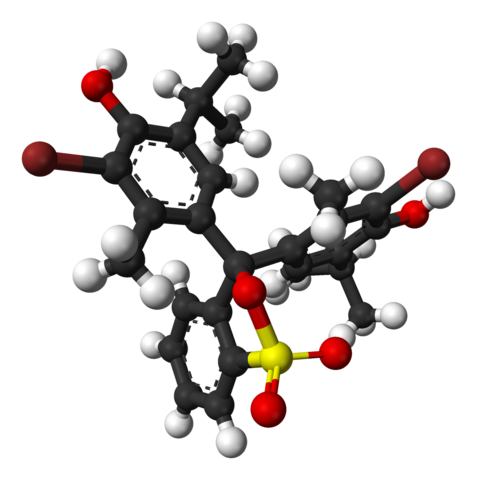 Chemische structuur van bromotimol blauw. Bron: Wikimedia Commons
Chemische structuur van bromotimol blauw. Bron: Wikimedia Commons In het bovenste beeld wordt de structuur van bromotimol blauw weergegeven met een staafmodel en bollen tot een pH minder dan 7.1. Bruine staven komen overeen met broomatomen, twee in totaal.
Elk van de drie aromatische ringen componeert, naast de methylgroepen, CH3, En thermisch, de Timol -groep, en nadat hij een BR heeft gekoppeld, wordt de reden 'bromotimol' genoemd.
Kan u van dienst zijn: hydroxidenIn het onderste deel wordt de sulfonaatgroep getoond, R-SO3-, Met rode bollen en een geel. Deze groep kan worden gekoppeld via een atoom- of centrale koolstof die zich aansluit bij de drie aromatische ringen.
PH -veranderingen
Deze moleculaire structuur, hoewel het niet radicaal verandert met zure of basale pH, verandert zijn elektronische toestanden, weerspiegeld door kleurveranderingen van oplossingen.
Onder pH 7 is de indicator geel en neemt de structuur van het beeld aan, maar als de pH basend wordt, zijn de groepen -OH ongelukkig en kan een dubbele binding worden gevormd c = o.
Als gevolg hiervan verandert het geconjugeerde systeem van het molecuul (dat van al zijn dubbele resonantiebindingen) voldoende zodat elektronen niet langer dezelfde fotonen absorberen en de oplossing van geel tot blauwachtig wordt.
Als de pH aan de andere kant ver onder de 7 is, verandert de kleur van de indicator van geel naar rood. Hier is de verandering in het geconjugeerde systeem te wijten aan de protonatie van de groepen -OH a -oh2+. -
In zowel zuur als basisch medium verliest het molecuul stabiliteit, waarbij kleinere fotonen worden opgenomen om elektronische overgangen mogelijk te maken die verantwoordelijk zijn voor de kleuren waargenomen door toeschouwers.
De groene kleur waargenomen in de hoofdafbeelding is te wijten aan het volgende: wanneer pH bij 7 benaderen.1, een klein deel van de moleculen verliest protonen en neemt afscheid van een blauwe kleur die, mengen met geel, de groene kleur geeft.
Eigenschappen DBromootimol Blue
Chemische naam
Bromotimol blauw of 3.3'-dibromotimolsulfonafet.
Moleculaire formule
C27H28BR2OF5S.
Molecuulgewicht
624.384 g/mol.
Fysiek uiterlijk
Vast kleurstof variërend tussen roze en paars.
Kan u van dienst zijn: butanal: structuur, eigenschappen, gebruik en risico'sChemisch kenmerk
Werkt als een zwak zuur in oplossing. Wanneer het wordt geprotoneerd in een zuur medium, krijgt het een gele kleur, een neutrale pH is groen en wanneer deze onaangenaam is in een alkalische pH is het blauw.
Ionische dissociatieconstante (ka)
7.9 x 10-8.
Actieve indicatiebereik
pH 6.0 tot 7.6. Dit is te wijten aan de aanwezigheid van broomatomen die werken door elektronen te extraheren en twee matige elektronendonormroepen (alkylsubstituenten).
Dikte
1.25 g/cm3.
Smeltpunt
202 ° C (396 ° F).
Kookpunt
184.9 ° C.
Oplosbaarheid
Het is nauwelijks oplosbaar in water en olie. Het is ook weinig oplosbaar in niet -polaire oplosmiddelen zoals benzeen, tolueen en xyleen, en praktisch onoplosbaar in oliether. Het is oplosbaar in waterige oplossingen van alkalisten en alcohol.
Stabiliteit
Het is stabiel bij omgevingstemperatuur en onverenigbaar met sterke oxiderende middelen.
Lichtabsorptie
De geprotoneerde vorm heeft zijn maximale absorptie bij een golflengte (λ) van 427 nm, waardoor geel licht in zure oplossingen wordt verzenden, en de onbeschermde vorm heeft een maximale absorptie bij een golflengte (λ) van 602 nm, waardoor een licht blauw wordt overgedragen aan een lichtblauw naar alkalische pH.
Gebruik en toepassingen
In metabole studies
Bromotimol -blauw wordt gebruikt in tal van processen waarin koolstofdioxide (CO₂) wordt geproduceerd, met de daaruit voortvloeiende generatie van koolzuur (h2CO3), dat het medium verzendt, dat wordt bewezen door een verandering in de kleur van bromotimolblauw.
Als een persoon een lichamelijke oefening uitvoert en is verbonden met een buis die op zijn beurt in verband is met een container met een oplossing van bromotimolblauw, zal het volgende fenomeen worden waargenomen: als gevolg van de toename van de fysieke activiteit en het Metabolisme zal een toename van de CO₂ -productie optreden.
Kan u van dienst zijn: silicium: geschiedenis, eigenschappen, structuur, verkrijgen, gebruikDe co₂ zal reageren met water, die koolzuur produceert, h2CO3, dat later dissocieert dat de ion h+ en verzending van het medium. Dit resulteert in bromotimol blauw verkrijgt een gele kleuring, wat de zuurgraad van de omgeving benadrukt.
Bij verloskunde
Bromotimol Blue wordt gebruikt in de verloskunde om een vroege breuk van membranen te tonen. De vruchtwater heeft normaal gesproken een pH groter dan 7.7, dus bromotimol blauw zal blauw kleuren, wanneer het in contact komt met de vloeistof die ontsnapt aan de amnio.
Vaginale pH is meestal zuur, dus bromotimolblauw heeft een gele kleuring. De verandering van kleur in blauw manifesteert de aanwezigheid van vruchtwater in het vaginale gebied.
Andere gebruiken
Bromotimol Blue heeft ook toepassing in de volgende apparatuur en functies:
- Optische sensoren
- Detectiesystemen voor gasverbranding
- In de uitwerking van schilderijen, speelgoed, schoonmaakproducten, wasmiddelen en textiel
- Versness sensoren
- Als verse rijst -identificatie en ranzig
- Bij de detectie van micro -organismen.
Het wordt ook gebruikt in bacteriegroeianalyse, psychoactieve geneesmiddelen en tandheelkundige materialen.
Voorbereiding
100 mg bromotimol blauw wordt opgelost in 100 ml verdunde alcohol en filters indien nodig filters. Het wordt ook als volgt bereid: 50 mg bromotimol blauw wordt opgelost in een mengsel van 4 ml 0,02 N natriumhydroxide en 20 ml alcohol, waarbij 100 ml met water met water worden voltooid.
Referenties
- Voist l. Bromothymol Blue: Definitie, gebruik en formule. Studie hersteld.com
- Bromothymol blauwe pH -indicator, 1 oz. Hersteld van ScienceCompany.com
- Spectrofotometrische bepaling van PK van bromothymol blauwe indicator. Hersteld van FCH.Upol.CZ

