Zwavelgeschiedenis, eigenschappen, structuur, verkrijgen, gebruik

- 4096
- 1269
- Lonnie Rohan
Hij zwavel Het is een niet -metalen element dat onder zuurstof leidt, de groep calcogenen in het periodiek systeem. Het bevindt zich specifiek in groep 16 met periode 3 en wordt weergegeven met het chemische symbool S. Van zijn natuurlijke isotopen, de 32S slaapt veel (ongeveer 94% van alle zwavelatomen).
Het is een van de meest voorkomende elementen op aarde, die ongeveer 3% van zijn totale massa samenstelt. Dat wil zeggen dat als alle zwavel van de planeet werd ingenomen, twee gele manen konden worden gebouwd; Er zouden drie satellieten zijn in plaats van één. Het kan verschillende oxidatietoestanden aannemen (+2, -2, +4 en +6), zodat hun zouten talrijk zijn en de terrestrische cortex en kern verrijken.
 Zwavelkristallen. Bron: Pixabay.
Zwavelkristallen. Bron: Pixabay. Zwavel is synoniem met gele, slechte geuren en hel. De belangrijkste reden voor zijn slechte geuren is te wijten aan de afgeleide verbindingen; vooral gasvormig en organisch. Van de rest zijn hun mineralen solide en hebben kleuren met geel, grijs, zwart en wit (onder andere).
Het is een van de elementen die de meeste een breed aantal alotropen presenteren. Het kan worden gevonden als kleine en discrete moleculen van S2 of s3; Als ringen of cycli, zijnde ortorrombisch en monoklinische zwavel8 de meest stabiele en overvloedige van allemaal; en als spiraalvormige ketens.
Niet alleen wordt het gevonden in de landcortex in de vorm van mineralen, maar ook in de biologische matrices van ons lichaam. Het is bijvoorbeeld in cystine-, cysteïne- en methionine -aminozuren, in ijzer-, keratine- en vitamines -eiwitten. Het is ook aanwezig in knoflook, grapefruits, uien, kool, broccoli en cauliflor.
Chemisch is het een zacht element, en in afwezigheid van zuurstof vormen zwavelineralen en sulfaten. Brandt met een blauwachtige vlam en kan worden getoond als een amorfe of kristallijne vaste stof.
Ondanks dat het onmisbaar is voor de synthese van zwavelzuur, zeer corrosieve stof en het toekennen van onaangename geuren, is het eigenlijk een goedaardig element. Zwavel kan in elke ruimte worden opgeslagen zonder grote voorzorgsmaatregelen, zolang er branden worden vermeden.
[TOC]
Geschiedenis van zwavel
In de Bijbel
Zwavel is een van de oudste elementen in de geschiedenis van de mensheid; Zozeer zelfs dat zijn ontdekking onzeker is en het is niet bekend welke van de oude beschavingen het voor het eerst gebruikten (4000 jaar vóór Christus). Op dezelfde pagina's van de Bijbel kunt u deze vinden bij het helse vuur en de storingen.
Er wordt aangenomen dat de vermeende geur van de hel te maken heeft met vulkaanuitbarstingen. Zijn eerste ontdekker moest zeker mijnen van dit element tegenkomen als stof landt of gele kristallen in de buurt van een vulkaan.
Oudheid
Deze geelachtige vaste stof vertoonde al snel opmerkelijke genezingseffecten. De Egyptenaren gebruikten bijvoorbeeld zwavel om de ontstekingen van de oogleden te behandelen. Het verlichtte ook schurft en acne, een toepassing die tegenwoordig te zien is in zwavelzepen en andere dermatologische items.
De Romeinen gebruikten dit element in hun rituelen, zoals fumigante en bleken. Wanneer Librara SOS2, Gas dat de kamers overspoelde die zich met vocht mengen en een antibacterieel medium bieden en in staat zijn om insecten te vernietigen.
De Romeinen ontdekten, net als de Grieken, de hoge brandbaarheid van zwavel, dus werd het synoniem met vuur. De kleur van zijn blauwachtige vlammen moest de Romeinse circussen verlichten. Er wordt aangenomen dat de Grieken ondertussen dit element gebruikten om brandende wapens te maken.
De Chinezen aan hun kant leerde dat het mengen van zwavel met zoutpeter (kno3) en steenkool creëerde het zwarte buskruit dat een historische omzet betaalde, en die in de naties van toen grote eisen en interesse in dit mineraal werd gewekt.
Het kan u van dienst zijn: Circonium: geschiedenis, eigenschappen, structuur, risico's, gebruikModerne tijden
Alsof buskruit niet voldoende reden was om zwavel te begeren, kwamen zwavelzuur en industriële toepassingen al snel naar voren. En met de zwavelzuurstand werd de hoeveelheid rijkdom of welvaart van een land in relatie tot de consumptieniveaus van deze verbinding gemeten.
Het was pas in 1789 toen de briljante chemicus Antoine Lavoisier in staat was om zwavel te herkennen en als een element te classificeren. Vervolgens ontdekte de Duitse chemicus Eilhard Mitscherlich in 1823 dat zwavel voornamelijk op twee manieren kan kristalliseren: Rhomboédrica en monoklinisch.
De geschiedenis van zwavel volgde hetzelfde kanaal van zijn verbindingen en toepassingen. Met het enorme industriële belang van zwavelzuur vergezelde hij de vulkanisatie van rubbers, de synthese van penicilline, mijnbouwexploitatie, de raffinage van zwavel -rijke olie -raws, bodemvoeding, etc.
Eigenschappen
Fysiek uiterlijk
Wrens vast in stof of kristallen. De kleur is ondoorzichtig citroengeel, het is smakeloos en mist geur.
Vloeibaar uiterlijk
Vloeibare zwavel is enkelvoud omdat de initiële gele kleur rood wordt en intensiveert en donkerder wordt als het hoge temperaturen ondergaat. Als het brandt, zeg blauwe en heldere vlammen.
Molaire massa
32 g/mol.
Smeltpunt
115.21ºC.
Kookpunt
445ºC.
ontstekingspunt
160ºC.
Zelf -uitsluittemperatuur
232ºC.
Dikte
2.1 g/ml. Andere alotropen kunnen echter minder dicht zijn.
Molaire warmtecapaciteit
22.75 J/Mol · K
Radiocovolent
105 ± 15.00 uur.
Elektronegativiteit
2.58 Op de Pauling -schaal.
Polariteit
S-S-links zijn apolair omdat beide zwavelatomen dezelfde elektronegativiteit hebben. Dit maakt al zijn alotropen, cyclisch of in de vorm van ketens, Apolar; En daarom zijn de interacties met water inefficiënt en kunnen ze er niet in worden opgelost.
Zwavel kan echter worden opgelost in apolaire oplosmiddelen zoals koolstofdisulfide, CS2, en aromatisch (benzeen, tolueen, xyleen, etc.)).
Ionen
Zwavel kan verschillende ionen vormen, in het algemeen anionen. De bekendste van allemaal is sulfide, s2-. De s2- Het wordt gekenmerkt door omvangrijk te zijn en een zachte basis van Lewis.
Om een zachte basis te zijn, stelt de theorie vast dat het de neiging heeft om verbindingen te vormen met zachte zuren; Zoals overgangsmetaalkationen, inclusief geloof2+, PB2+ En Cu2+.
Elektronische structuur en configuratie
De zwavelkroon
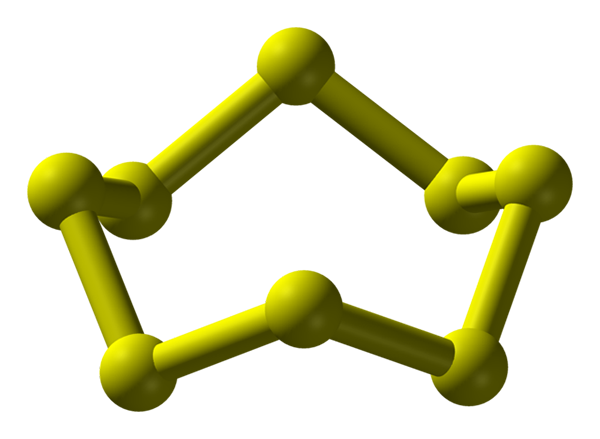 S8 -molecuul, de meest stabiele en overvloedige alotrope van zwavel. Bron: Benjah-bmm27.
S8 -molecuul, de meest stabiele en overvloedige alotrope van zwavel. Bron: Benjah-bmm27. Zwavel kan optreden in een breed scala van alotropen; en deze hebben op hun beurt kristallijne structuren die worden gemodificeerd onder verschillende drukken en/of temperaturen. Daarom is zwavel een rijk element in alotropo's en polymorfen, en de studie van zijn vaste structuren vertegenwoordigt een eindeloze bron van theoretisch-experimentele werken.
Waarom zo'n structurele complexiteit? Om te beginnen zijn covalente bindingen in zwavel (S-S) zeer sterk, alleen worden overwonnen door koolstof, C-C en door waterstof, H-H.
Zwavel, in tegenstelling tot koolstof, neigt niet om tetraëder te vormen, maar boemerangs; dat ze met hun hoeken vouwen en rinkelen om zwavelketens te stabiliseren. De bekendste ring van allemaal, die ook de meest stabiele alotrope van zwavel vertegenwoordigt, is de S8, De "zwavelkroon" (hoger beeld).
Merk op dat alle S-S-links8 Ze lijken individuele boemerangs, wat resulteert in een ring met plooien en helemaal plat. Deze kronen s8 Ze interageren via Londense troepen, zo georiënteerd dat ze erin slagen om structurele patronen te creëren die een ortorrombisch kristal definiëren; genaamd s8 α (S-α, of gewoon ortorrombische zwavel).
Kan u van dienst zijn: elastische materialenPolymorfen
De zwavelkroon is een van de vele alotropen voor dit element. De s8 α is een polymorf van deze kroon. Er zijn twee anderen (een van de belangrijkste) genaamd S8 β en s8 γ (respectievelijk S-β en S-γ). Beide polymorfen kristalliseren in monokliene structuren, zijnde de S8 γ is dichter (zwavelgamma).
De drie zijn gele vaste stoffen. Maar hoe wordt elke polymorfen afzonderlijk verkregen?
De s8 β bereidt de S voor8 α bij 93 ° C, waardoor de langzame koeling zijn terugkeerovergang naar de ortorrombische fase (de α) kan vertragen. En de S8 γ wordt daarentegen verkregen wanneer het is gebaseerd8 α bij 150 ° C, waardoor het opnieuw langzaam kan afkoelen; Het is de dichtste van de zwavelkroonpolymorfen.
Andere cyclische alotropen
De kroon s8 Het is niet de enige cyclische alotroop. Er zijn anderen zoals S4, S5 (Analoog naar cyclopentano), s6 (vertegenwoordigd door een zeshoek en de cyclus), s7, S9, en s10-20; Dit laatste betekent dat er ringen of cycli kunnen zijn die van tien tot twintig zwavelatomen bevatten.
Elk van hen vertegenwoordigt verschillende zwavelcyclische alotrochs; En op zijn beurt, om het te benadrukken, hebben ze variëteiten van polymorfen of polymorfe structuren die afhankelijk zijn van druk en temperatuur.
Bijvoorbeeld de s7 Het heeft maximaal vier bekende polymorfen: α, β, γ en δ. De leden of kronen van hogere moleculaire massa's zijn organische syntheseproducten en overheersen niet in de natuur.
Zwavelketens
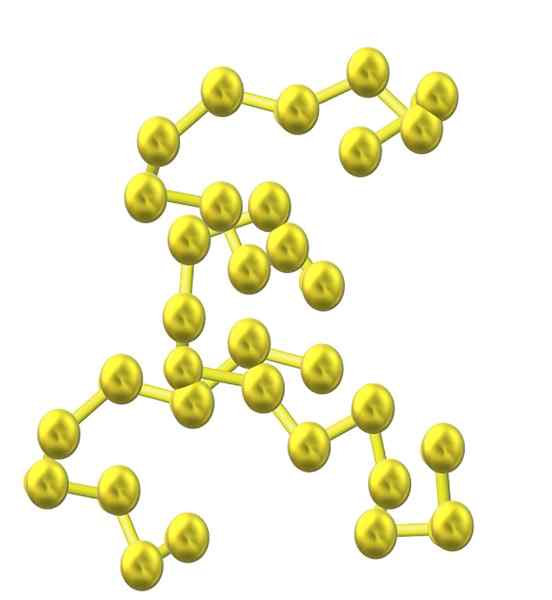 Zwavelketen. Bron: OpenTax [CC door 4.0 (https: // creativeCommons.Org/licenties/door/4.0)]
Zwavelketen. Bron: OpenTax [CC door 4.0 (https: // creativeCommons.Org/licenties/door/4.0)] Naarmate meer zwavelatomen in de structuur worden opgenomen, blijven hun neiging om afname te rinkelen en blijven zwavelketens open en nemen ze spiraalvormige conformaties aan (alsof het spiralen of schroeven zijn).
En dus ontstaat een andere volumineuze familie van zwavel alotrops die niet bestaat uit ringen of cycli maar uit ketens (zoals het superieure beeld).
Wanneer deze S-S-ketens parallel aan het glas aansluiten, vangen ze onzuiverheden en definiëren ze uiteindelijk een vezelachtige vaste stof die vezelige zwavel wordt genoemd, of S-ψ. Als er een van deze parallelle ketens zijn covalente bindingen die ze verbinden (zoals bij de vulkanisatie van rubber), hebben we laminaire zwavel.
Wanneer zwavel8 Het smelt een geelachtige vloeistoffase die donker kan worden als de temperatuur wordt verhoogd. Dit komt omdat S-S-links worden verbroken en daarom een thermisch depolymerisatieproces voorkomt.
Deze vloeistof wanneer koelt toont plastic kenmerken en vervolgens glazig; dat wil zeggen, een glasachtige zwavel en amorfe (S-Were) worden verkregen. De samenstelling bestaat uit zowel ringen als zwavelketens.
En wanneer een mengsel van de vezelachtige en laminaire alotroop wordt verkregen uit de amorfe zwavel, een commercieel product dat wordt gebruikt voor de vulkanisatie van rubber.
Kleine alotropen
Hoewel ze als laatste worden achtergelaten, zijn ze niet minder belangrijk (of interessant) dan de alotropo's van de grootste moleculaire massa's. S2 en s3 zijn de gesulfuriseerde versies van de O2 I3. In de eerste twee zwavelatomen voegen ze zich aan met een dubbele binding, s = s, en in de tweede zijn er drie atomen met resonantiestructuren, s = s-s.
Beide s2 zoals de S3 Ze zijn gasvormig. De s3 Manifesteer een kersenrode kleuring. De twee hebben voldoende bibliografisch materiaal om elke dekking van een individueel artikel te bedekken.
Elektronische configuratie
De elektronische configuratie voor het zwavelatoom is:
[Ne] 3s2 3P4
U kunt twee elektronen verdienen om uw octeto Valencia te voltooien en dus een oxidatietoestand van -2 te hebben. Evenzo kunt u elektronen verliezen, beginnend met twee in zijn 3p -orbitalen, zijnde de oxidatietoestand van +2; Als u nog twee elektronen verliest, met uw lege 3P -orbitalen, is uw oxidatiestatus +4; En als u alle elektronen verliest, is dit +6.
Kan u van dienst zijn: metalloïdenHet verkrijgen waar is zwavel?
Mineralogisch
Zwavel maakt deel uit van veel mineralen. Onder hen zijn de pyriet (FES2), La Galena (PBS), Covellita (CUS) en andere sulfaat- en sulfidenmineralen. Door ze te verwerken, kunnen niet alleen metalen worden geëxtraheerd, maar ook zwavel na een reeks reductieve reacties.
Het kan ook puur worden verkregen in vulkanische ventilatieopeningen, waar wanneer de temperatuur wordt verhoogd en bergafwaarts wordt gemorst; En als hij in brand stopt, zal hij eruit zien als een blauwachtige lava. Door zwaar werk en inspannende fysieke werken kan zwavel worden verzameld omdat het vrij vaak op Sicilië werd gedaan.
Zwavel is ook te vinden in ondergrondse mijnen, die zijn gemaakt om oververhit water te pompen om te smelten en over te brengen naar het oppervlak. Dit verkrijgproces staat bekend als een brasch -proces, momenteel weinig gebruikt.
Petroleum
Tegenwoordig komt het grootste deel van de zwavel uit de olie -industrie, omdat de organische verbindingen deel uitmaken van de samenstelling van de olie -ruwe olie en de verfijnde derivaten.
Als een verfijnde ruwe olie of product rijk is aan zwavel en hydrodesulfurisatie ondergaat, zal het grote hoeveelheden h afgeven2S (stinkend gas dat naar rotte eieren ruikt):
R-S-R + 2 H2 → 2 RH + H2S
Dan h2S Het is chemisch in het clauss -proces, samengevat met de volgende chemische vergelijkingen:
3 o2 + 2 H2S → 2 Dus2 + 2 H2OF
SW2 + 2 H2S → 3 S + 2 H2OF
Toepassingen
Een deel van het gebruik voor zwavel wordt hieronder en in het algemeen vermeld:
- Het is een essentieel element voor zowel planten als dieren. Het is zelfs aanwezig in twee aminozuren: cysteïne en methodin.
- Het is de grondstof voor zwavelzuur, samengesteld bij het bereiden van ontelbare commerciële producten.
- In de farmaceutische industrie is het bedoeld voor de synthese van zwavelderivaten, de penicilline is de bekendste van de voorbeelden.
- Maakt de vulkanisatie van rubbers mogelijk door polymere ketens te verbinden met S-S-links.
- De gele kleur en mengsels met andere metalen maken het wenselijk in de pigmentindustrie.
- Gemengd met een anorganische matrix, zoals zand en rotsen, wordt beton en zwavelasfalt bereid voor de vervanging van het bitumen.
Risico's en voorzorgsmaatregelen
Zwavel op zichzelf is een onschadelijke, niet -toxische stof en vertegenwoordigt ook potentiële risico's, tenzij ze reageren op andere verbindingen. De sulfaatzouten zijn niet gevaarlijk en kunnen zonder grote voorzorgsmaatregelen worden gemanipuleerd. Dit gebeurt echter niet met zijn gasvormige derivaten: dus2 en h2S, beide extreem giftig.
Als het zich in een vloeibare fase bevindt, kan het ernstige brandwonden veroorzaken. Als het in grote hoeveelheden overspoelt, kan H worden geactiveerd2S in de darm. Voor de rest vormt het geen risico voor degenen die kauwen.
In het algemeen is zwavel een zeker element dat niet te veel voorzorgsmaatregelen vereist, behalve dat het weghoudt van brand en sterke oxiderende middelen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Laura Crapanzano. (2006). Polymorfisme van zwavel: structurele en dynamische aspecten. Natuurkunde [natuurkunde].Universiteit Joseph -fourier - Grenoble i. Engels. Fftel-00204149f
- Wikipedia. (2019). Allotropen van zwavel. Opgehaald uit: in.Wikipedia.borg
- Meyer beat. (1976). Elementaire zwavel. Chemische beoordelingen, vol. 76, nee. 3.
- Dr. Doug Stewart. (2019). Feiten voor zwavelelementen. Chemicool. Hersteld van: chemicool.com
- Donald W. Davis en Randall a. Detro. (2015). Zwavelgeschiedenis. Georgia Gulf Sulphur Corporation. Hersteld van: Georgiagulfsulfur.com
- Helmestine, Anne Marie, pH.D. (11 januari 2019). 10 interessante zwavelfeiten. Hersteld van: Thoughtco.com
- Boone, c.; Bond, c.; Hallman, een.; Jenkins, J. (2017). Algemeen zwavelfactblad; National Pesticide Information Center, Oregon State University Extension Services. NPIC.Orst.Edu
- « Onafhankelijkheid van Mexico Oorzaken, ontwikkeling, gevolgen, karakters
- Flora en fauna van Jalisco -representatieve soorten »

