Asparagineigenschappen, structuur, functies, biosynthese
- 2217
- 621
- Dewey Powlowski
De Asparagina (Asn of n) is een belangrijk aminozuur voor celsignalering en de vereniging tussen eiwitten en koolhydraten. Dit is een van de 22 basisaminozuren en wordt gecatalogiseerd als niet -essentieel, zoals het wordt gesynthetiseerd door het lichaam van zoogdieren.
Dit aminozuur wordt geclassificeerd binnen de groep polaire aminozuren zonder belasting en was het eerste kale aminozuur, een feit dat plaatsvond in 1806, waar het werd geïsoleerd uit het aspergesap (een soort kruidachtige plant) door de Franse chemicaliën Vauquelin en Robiquet.
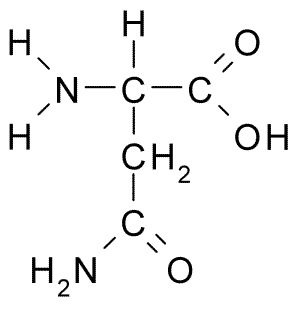
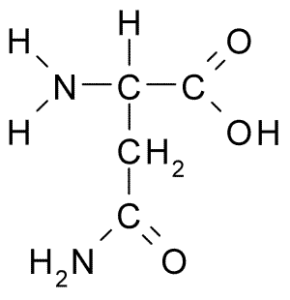 Chemische structuur van aminozuur -asparagine (Bron: Borb, via Wikimedia Commons)
Chemische structuur van aminozuur -asparagine (Bron: Borb, via Wikimedia Commons) Ondanks de vroege ontdekking werd de biologische en voedingsrol van asparagine niet erkend, maar meer dan 100 jaar later, toen, in 1932, de aanwezigheid ervan in de structuur van een eiwit in de hennepzaden werd bevestigd.
Asparagine en glutamine dienen als substraten voor de gemalen groepen van twee zeer frequente aminozuren in eiwitten: aspartisch (asparaginezuur) en glutamaat (glutaminezuur), respectievelijk. Asparagine en glutamine worden gemakkelijk gehydrolyseerd in deze aminozuren door enzymatische werking of zuur en basisverbindingen.
Veel protease serinetyymen die verantwoordelijk zijn voor hydrolyserende peptidebindingen hebben asparagine in de zijketen van hun actieve plaats. Dit residu heeft een negatieve gedeeltelijke belasting en is verantwoordelijk voor het samenvoegen van een complementaire manier met de positieve belasting van de witte peptiden, die de snijlocatie naderen.
Het enzym dat wordt beschuldigd van de oxalacetaatsynthese van asparagine wordt gebruikt in chemotherapeutische behandelingen en staat bekend als L-asparaginase, dat verantwoordelijk is voor het katalyseren van de hydrolytische fragmentatie van het amida van asparagine tot aspartaat en ammonium.
Asparaginase wordt tot overexpressie en gezuiverd van Escherichia coli, Worden geïnjecteerd bij kinderpatiënten met acute lymfatische leukemie, omdat zowel normale als kwaadaardige lymfocyten afhankelijk zijn van de vangst van asparagine in het bloed voor groei en vermenigvuldiging.
[TOC]
Kenmerken en structuur
Alle chemische structuren van de aminozuren hebben een carboxylgroep (-coh), een aminogroep (-nh3+), een waterstof (-H) en een R- of substituerende groep die verenigd zijn door hetzelfde centrale koolstofatoom, bekend als koolstof α.
Aminozuren verschillen van elkaar door de identiteit van hun zijketens, die die bekend zijn als R -groepen en die kunnen variëren in grootte, structuur, functionele groepen en zelfs elektrische lading.
Koolstofatomen van R -groepen identificeren zich met letters uit het Griekse alfabet. Aldus worden in het geval van asparagine de koolstofatomen van de R -keten geïdentificeerd als β- en γ -koolstofatomen.
Kan u van dienst zijn: agar xld: foundation, voorbereiding en gebruikVolgens een ander type nomenclatures wordt het koolstofatoom in de carboxylgroep (-coh) vermeld als C-1, dus, doorgaan met de nummering, zou de koolstof α C-2 zijn enzovoort,.
Een asparaginemolecuul heeft vier koolstofatomen, waaronder koolstof α, carboxylgroep koolstof en twee koolstofatomen die deel uitmaken van de R-groep, bekend als carboxamide (-CH2-Co-Co-NH2).
Deze carboxamidegroep wordt alleen gevonden in twee aminozuren: in asparagine en glutamine. Het heeft het kenmerk dat het met veel gemak waterstofbruggen kan vormen via de aminogroep (-NH2) en de carbonylgroep (-co).
Classificatie
Asparagine behoort tot de groep polaire aminozuren zonder belasting, die zeer oplosbare aminozuren in water zijn en zeer hydrofiel (vanwege hun vormingscapaciteit van meerdere waterstofbruggen).
In de groep polaire aminozuren zonder belasting zijn ook de serine, Treonine, Cysteïne en Glutamine. Dit zijn allemaal verbindingen "Zwitterionics”, Omdat ze een polaire groep in zijn R -keten hebben die bijdraagt aan de neutralisatie van de belastingen.
Alle polaire aminozuren zonder belasting zijn niet ioniseerbaar in pH bijna 7 (neutraal), dat wil zeggen, ze hebben geen positieve of negatieve ladingen. In zure en basismedia worden substituenten echter geïoniseerd en verwerven ze een last.
Stereochemie
De centrale koolstof of α -koolstof van de aminozuren is een chirale koolstof, dan heeft het vier verschillende verenigde substituenten, die ten minste twee onderscheidbare stereoisomeren voor elk aminozuur veroorzaakt.
Stereoisomeren zijn spiegelende beelden van een molecuul die dezelfde moleculaire formule hebben, maar zijn niet overtollig met elkaar, zoals handen (links en rechts). Ze worden aangeduid met de letter D of L, omdat experimenteel de oplossingen van deze aminozuren het gepolariseerde lichtvlak in tegengestelde richtingen roteren.
De algemene asymmetrie van aminozuren maakt de stereochemie van deze verbindingen van groot belang, omdat elk verschillende eigenschappen heeft, wordt gesynthetiseerd en neemt deel aan verschillende metabole routes.
Asparagine is te vinden in de vorm van D-asparagine of L-asparagine, waarbij de laatste de meest voorkomende aard is. Het wordt gesynthetiseerd door L-synthesase en gemetaboliseerd voor L-asparaginase, beide enzymen zijn zeer overvloedig in de gewervelde lever.
Functie
Het gemak van het vormen van asparagine waterstofbruggen maakt het een cruciaal aminozuur voor de structurele stabiliteit van eiwitten, omdat het interne waterstofbruggen kan vormen met de laterale ketens van de andere aminozuren die ze vormen.
Kan u van dienst zijn: 25 voorbeelden van aseksuele reproductieAsparagine wordt meestal aangetroffen op het oppervlak van typische waterige media, waardoor hun structuur wordt gestabiliseerd.
Veel glycoproteïnen kunnen binden aan koolhydraten of koolhydraten door middel. In het geval van asparagine wordt een acetylgalactosamine in het algemeen verbonden met de aminogroep door N-glycycosylatie.
Het is belangrijk om te benadrukken dat koolhydraten in alle N-glycosyleerde glycoproteïnen hieraan binden door een asparaginestaat dat zich in een specifiek gebied bevindt dat is aangeduid als ASN-X-Ser/Thr, waarbij X een aminozuur is.
Deze glycoproteïnen worden geassembleerd in het endoplasmatische reticulum, waar ze glycosyleerd zijn als ze worden vertaald.
Biosynthese
Alle eukaryotische organismen assimileren ammoniak en transformeren deze in glutamaat, glutamine, carbamil-fosfaat en asparagine. Asparagine kan worden gesynthetiseerd uit glycolytische tussenpersonen, in de citroenzuurcyclus (van oxalacetaat) of van de voorlopers die in het dieet worden geconsumeerd.
Het synthetase -asparagine -enzym is een amidotransferase -afhankelijk van glutamine en ATP dat de ATP en anorganische pyrofosfaat (PPI) (PPI) spuugt en de ammoniak of glutamine gebruikt om een amidatiereactie te katalyseren en het aspartaat om te zetten in aspartaat.
Zowel bacteriën als dieren hebben een synthetase -asparagine, maar in bacteriën gebruikt het enzym het ammoniumion als stikstofdonor, terwijl bij zoogdieren de synthetische synthesase glutamine gebruikt als de belangrijkste donor van de stikstofgroep.
De enzymatische breuk van de ATP tot versterker en anorganisch pyrofosfaat (PPI), samen met glutamine als donor van de Amida-groep, zijn de belangrijkste verschillen met betrekking tot de biosynthese van L-glutamine tussen de verschillende organismen.
Degradatie
De meeste studies naar asparaginemetabolisme zijn uitgevoerd in planten, gezien het feit dat studies bij zoogdieren aanvankelijk werden gehinderd door het ontbreken van methoden die gevoelig genoeg zijn voor aminozuurtests op het niveau van complexere systemen.
L-asparagine wordt constant gehydrolyseerd bij zoogdieren door L-asparaginase om asparaginezuur en ammonium te veroorzaken. Het wordt gebruikt voor de synthese van glycoproteïnen en is een van de belangrijkste voorlopers van oxalacetaat voor de citroenzuurcyclus.
Asparaginase-enzym katalyseert asparaginehydrolyse tot aspartaat, vervolgens wordt aspartaat getransamineerd met a-cetoglutaraat om glutamaat en oxalacet te produceren.
Kan je van dienst zijn: epiblastSyntheta-asparagine, ook bekend als aspartaat-amoniaco-ligase, wordt overvloedig gevonden van hersencellen van zoogdieren.
Wanneer lage niveaus van dit enzym in het lichaam worden waargenomen, wordt wat bekend staat als "aminoacidopathieën" gevormd, omdat voorloper -substraten zich ophopen in het cytoplasma van hersencellen.
Voedsel rijk aan asparagine
Mensen met acute lymfatische leukemie hebben meestal tekortkomingen met betrekking tot het synthetase -asparagine -enzym en zijn afhankelijk van asparagine in circulatie, dus ze worden een dieet aanbevolen in voedingsmiddelen die rijk zijn aan asparagine of de exogene voorraad van hetzelfde.
Een van de meerdere voedingsmiddelen met een hoog asparaginegehalte is zij.
Er zijn L-asparagineconcentraten die zijn geformuleerd voor atleten met hoge competitie, omdat hun consumptie helpt om de eiwitten te regenereren die de weefsels vormen.
Bovendien nemen mensen met een tekort aan aminozuursynthese ook deze tabletten op om aandoeningen in hun centrale zenuwstelsel te voorkomen.
Asparagine is gemakkelijker te metaboliseren door zijn L-asparagine-vorm, omdat veel van de enzymen die bij hun metabolisme betrokken zijn de D-asparaginevorm niet herkennen en daarom niet alle asparagine die in voedsel is ingenomen, beschikbaar is voor verschillende organisme-processen.
De overvloedige asparagine -inname kan gunstig zijn, maar het wordt niet aanbevolen.
Referenties
- Cooney, D. NAAR., Capizzi, r. L., & Handschumacher, r. EN. (1970). Evaluatie van L-asparagine-metabolisme bij anims en man. Kankeronderzoek, 30 (4), 929-935
- Dunlop, p. C., Roon, r. J., & Zelfs, h. L. (1976). Gebruik van D-asparagine door Saccharomyces cerevisiae. Journal of Bacteriology, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, e., & MARSOLAIS, F. (2017). Vooruitgang in asparagine metabolisme. In Vooruitgang in plantkunde Vol. 79 (PP. 49-74). Springer, Cham.
- Kornfeld, r., & Kornfeld, s. (1985). Montage van asparagine-gekoppelde oligosacchariden. Jaaroverzicht van biochemie, 54 (1), 631-664
- Mathews, c. K., & Ahern, k. G. (2002). Biochemie. Pearson Education.
- Nelson, D. L., Lehninger, een. L., & Cox, m. M. (2008). Lehninger -principes van biochemie. Macmillan.
- Yamada, K., Hashizume, D., Shimizu, t., & Yokoyama, s. (2007). L-asparagine. Kristallografische handeling Sectie E: Structuurrapporten online, 63 (9), 3802-3803.

