Ondersteuningsfuncties, functies en voorbeelden
- 1209
- 336
- Pete Heaney V
De steunt Het zijn de inactieve vormen van enzymen, dat wil zeggen dat het de enzymen zijn die hun cofactoren of co -enzymen missen, die essentieel zijn om de katalytische reacties uit te voeren waarvan ze de leiding hebben.
Enzymen zijn eiwitten met katalytische activiteit. De functie ervan versnelt in feite het verloop van verschillende soorten chemische reacties in de cellen, een feit dat erg belangrijk is voor het bestaan van alle levende wezens op aarde.
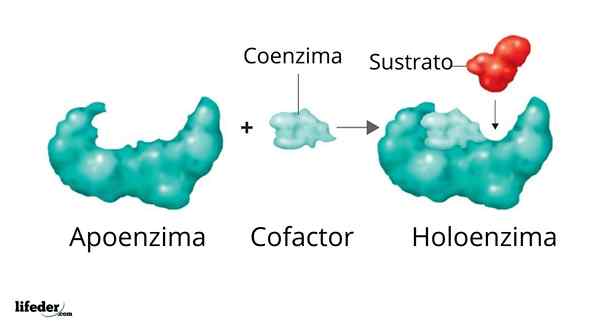
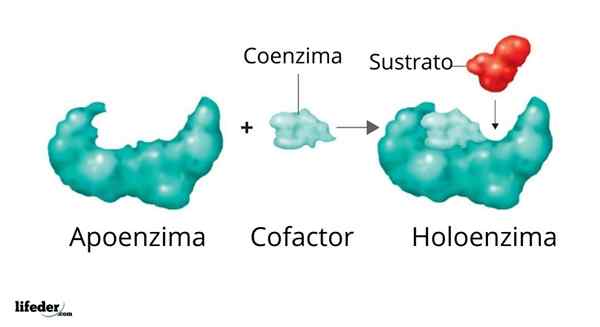 Een holoenzym wordt gevormd door een supporter en zijn cofactor/co -enzym/prothetische groep
Een holoenzym wordt gevormd door een supporter en zijn cofactor/co -enzym/prothetische groep De activiteit van veel enzymen hangt af van de identiteit en het ordenen van de aminozuren die deze omvatten, dat wil zeggen, van hun eigen eiwitstructuren, en van de integriteit van deze structuren in omstandigheden oorspronkelijk.
Hoewel dit voor veel enzymen geldt, zijn er enkele die extra niet -eiwitse elementen vereisen om hun functies uit te voeren. Dergelijke elementen staan bekend als Cofactors, Als dit anorganische ionen zijn, of co -enzymen, Als dit complexe of organische moleculen zijn.
Over het algemeen worden zowel cofactoren als co -enzymen geassocieerd met relatieve stabiliteit met de eiwitstructuur van enzymen waarvan de katalytische activiteit promoot; Wanneer deze associatie permanent (covalent) is, worden deze groepen dan bekend als Prothetische groepen.
Voorbeelden van ondersteuning
 3D -illustratie van DNA -polymerase
3D -illustratie van DNA -polymerase De actieve enzymatische set gevormd door een eiwit met katalytische activiteit en de cofactor/co -enzym/prothetische groep wordt genoemd Holoenzym of geconjugeerd enzym. In een holoenzym komt het eiwitgedeelte overeen met wat bekend staat ondersteunend of apoproteïne, dat geen activiteit heeft.
Voorbeelden van enkele belangrijke ondersteuning zijn:
- Het enzym DNA -polymerase, Verantwoordelijk voor het repliceren van cel -DNA, zonder het tweewaardige magnesiumion dat als een cofactor dient.
- Het enzym Koolhydrase, De leiding over het katalyseren van de conversie van CO₂ en H₂0 in bicarbonaat en H+ionen, zonder het tweewaardige zinkion dat dient als een cofactor.
- Het enzym hemoglobine, De leiding over het transport van zuurstof in de rode bloedcellen (erytrocyten) door het bloed van zoogdieren, zonder hun prothetische groep Hemo.
- Het enzym lactaatdehydrogenase, Laad voor de productie van lactaat uit pyruvaat, zonder de NADH die dient als een cofactor.
Kenmerken van apoenzymen
De ondersteuning zijn inactieve enzymen die ze nodig hebben, om hun activering te bereiken, de unie van een cofactor of een co -enzym, maar die niet verenigd zijn.
Hiermee rekening houdend kan worden gezegd dat dergelijke moleculen bepaalde kenmerken delen, namelijk:
Het zijn eiwitten
In tegenstelling tot cofactors en co -enzymen, die niet -eiwitselementen zijn die nodig zijn voor de functies van holoenzymen, zijn ondersteuning eiwitten.
De vorige verklaring wordt dus begrepen dat steunen worden gevormd door ketens van speciale moleculen die bekend staan als aminozuren, die aan elkaar zijn gekoppeld via een type link dat bekend staat als peptidebinding.
De aminozuursequentie van elke ondersteuning wordt genetisch bepaald en dit geeft op zijn beurt de ruimtelijke of drie -dimensionale volgorde aan, nauw verbonden met de specificiteit van substraten, de unie aan de cofactors/co -enzymen/prothetische groepen, oprichting van de actieve site, enz.
Als eiwitten hebben apoenzymen ook: een elektrische lading, bepaald door hun aminozuurgehalte en de pH van het medium waar ze worden gevonden; Temperatuur-, pH- en ionische krachtvereisten Kenmerk, waarbij het in aanwezigheid van cofactoren met hun optimale snelheid kan functioneren; Remmers en concurrenten, enz.
Ze kunnen lid worden van substraten
Hoewel ze op zichzelf niet in staat zijn om een enzymatische reactie te katalyseren, behouden veel steunen het vermogen om zich aan te sluiten bij de substraten die deelnemen aan de reactie die hen kenmerkt; Om deze reden worden ze meestal gebruikt in sommige experimentele contexten.
Ze kunnen lid worden van cofactors, co -enzymen of prothetische groepen
In de meeste gevallen kunnen steunen worden beschouwd als inactieve enzymen die dat zijn voorbereid Om lid te worden van die moleculen die hun functies bijwonen, dat wil zeggen: voor hun cofactors, co -enzymen of prothetische groepen.
Het kan je van dienst zijn: flora en fauna van de Ecuadoriaanse kustCofactoren kunnen rechtstreeks deelnemen aan katalytische reacties of eenvoudig bijdragen aan de stabilisatie van de algemene structuur van holoenzyme.
Onder de belangrijkste cofactoren die deelnemen aan celholoenzymen zijn:
- IJzer (Fe2+)
- Koper (Cu2+)
- Calcium (Ca2+)
- Zink (Zn2+)
- Magnesium (mg2)
- Mangaan (MN2+)
- Kobalt (CO)
- Nikkel (Ni)
Onder de belangrijkste co -enzymen kan worden benoemd:
- Vitamines: B9, B3, C
- Adenosín Triffosfate (ATP)
- Flavín Adenín Dinucleotide (FAD)
- Nicotinamide of Nicotín dinucleotide dycleotide (NAD)
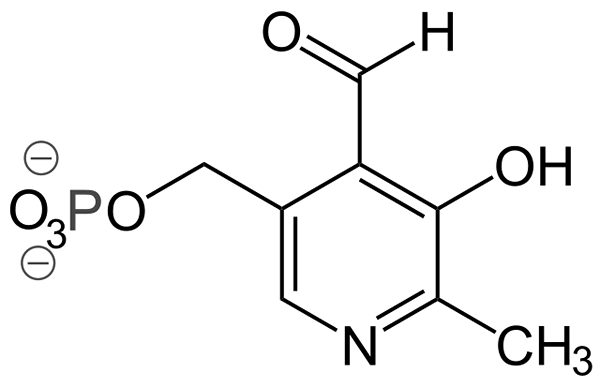 Piridoxal-fosfaatstructuur (Bron: Ayacop, Public Domain, via Wikimedia Commons)
Piridoxal-fosfaatstructuur (Bron: Ayacop, Public Domain, via Wikimedia Commons) Sommige belangrijke prothetische groepen zijn:
- Hemo -groep
- Biotine
- Thiamine pyrofosfaat
- Pyridoxal-fosfaat
Functies van de subenzima's
Aangezien steunen de eiwitgedeelten van holoenzymen zijn, is het eerlijk om ze als hun belangrijkste onderdeel te beschouwen. Zelfs in aanwezigheid van de juiste co -enzymen, co -enzymen en substraten, zonder de steunen, kon geen van de enzymatische reacties die door deze enzymen worden gekatalyseerd, worden uitgevoerd.
In die zin is de belangrijkste functie van een ondersteuning om zowel de hoofdstructuur van het holoenzym waaraan het behoort, bij te dragen, als de site van Union voor de cofactor, het co -enzym en/of prothetische groep en de substraten die deelnemen aan de reactie.
Vanuit structureel oogpunt is een holoenzyme zonder zijn apoenzyme niets meer dan een cofactor, en een cofactor alleen is niets meer dan een relatief inert molecuul (biologisch gezien), zodat de steun in werkelijkheid de leiding heeft De katalytische reactie, bijgestaan door de genoemde niet -eiwitselementen.
Kan u van dienst zijn: actinomycetesDe functies van de ondersteuning, hoewel het inactieve enzymen is, zijn dus afhankelijk van:
- De lineaire keten van aminozuren of primaire structuur (als het enzymatische complexen zijn gevormd door meer dan één subeenheid, dan zou het worden besproken over "hun lineaire ketens").
- De manier waarop deze ketens in de ruimte worden besteld, dat wil zeggen secundaire, tertiaire en quaternaire structuren, wanneer de zaak.
- De juiste conformatie van de locaties die fundamenteel zijn voor katalyse, dat wil zeggen de katalytische plaats met de aminozuren die deelnemen aan de reactie, de vakbondsplaats voor de co -enzymen, co -enzymen of prothetische groepen; enz.
- De stabiliteit van de structuur in celomstandigheden of oorspronkelijk, Feit dat direct gerelateerd is aan het vermogen van apoenzyme om holoenzyme te vormen, en andere.
Referenties
- Boyer, p. D., & Krebs, en. G. (1986). De enzymen. Academische pers.
- Garrett, r. H., & Grisham, c. M. (2001). Principes van biochemie: met een menselijke focus. Brooks/Cole Publishing Company.
- Gruber, k., Puffer, b., & Kräutler, B. (2011). Vitamine B 12-derivaten-enzym co-factoren en liganden van eiwitten en nucleïnezuren. Chemical Society Reviews, 40 (8), 4346-4363.
- Murray, r. K., Granner, D. K., Mayes, p. NAAR., & Rodwell, V. W. (2014). Harper's geïllustreerde biochemie. McGraw-Hill.
- Nelson, D. L., Lehninger, een. L., & Cox, m. M. (2008). Lehninger -principes van biochemie. Macmillan.
- Staiano, m., Pennacchio, een., VARRIALE, A., Capo, a., Majoli, a., Capacchione, c., & D'Auria, s. (2017). Enzymen als sensoren. In methoden in enzymologie (vol. 589, pp. 115-131). Academische pers.
- « Indiener voor wat het nut is, bijvoorbeeld, formaat (model)
- Branchial ademen hoe het wordt gedaan en voorbeelden »

