Antimoongeschiedenis, structuur, eigenschappen, gebruik en risico's

- 2650
- 225
- Ernesto McKenzie
Hij antimoon Het is een glanzende, zilveren metalloïde en met een bepaalde blauwe tint. De vaste stof wordt ook gekenmerkt door zeer bros en van plaveiseltextuur. Het behoort tot groep 15 van het periodiek systeem, geleid door stikstof. Na de bismut (en de Moskouium) is het het zwaarste element van de groep.
Het wordt weergegeven door het SB -chemisch symbool. In de natuur wordt het voornamelijk gevonden in stabit- en ullmannite -mineralen, wiens chemische formules SB zijn2S3 en nisbs, respectievelijk. De hoge neiging om sulfiden te vormen in plaats van oxiden is omdat het chemisch zacht is.
 Kristallijn antimoon. Bron: Beste sci-fatcs [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Kristallijn antimoon. Bron: Beste sci-fatcs [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Aan de andere kant is het antimoon ook fysiek zacht, met een hardheid van 3 op de MOHS -schaal. Het is stabiel bij kamertemperatuur en reageert niet met luchtzuurstof. Maar wanneer verwarmd in aanwezigheid van zuurstof, vormt hij het antimoontrioxide, SB2OF3.
Het is ook resistent tegen de werking van zwakke zuren; Maar heet wordt aangevallen door stikstof- en zoutzuurzuren.
Het antimoon heeft talloze toepassingen, waaronder wordt gebruikt in legeringen met lood en tin, bij de vervaardiging van batterijen voor voertuigen, lage wrijvingsmaterialen, enz.
Deze metalloïde heeft het zeldzame eigendom om het volume te vergroten wanneer gestold, waardoor zijn legeringen de ruimte volledig kunnen bezetten die wordt gebruikt om het instrument te vormen dat gewenst is om te produceren.
[TOC]
Geschiedenis van uw ontdekking
BC
Er zijn aanwijzingen dat van 3100 tot.C, antimoonsulfide werd gebruikt als cosmetisch in Egypte. In Mesopotamië, de huidige Irak, blijft van een vaas en een ander artefact gevonden dat naar verluidt dateren tussen de 3000 en 2200 jaar tot.C, waarin het werd gebruikt in zijn antimoonverdeling.
Introductie van de term
Roman Erúdito Plinio El Viejo (23-79 D.c) beschreef het gebruik van antimoon, dat hij Estibio noemde, in de uitwerking van zeven medicijnen in zijn natuurlijke geschiedenisverdrag. Alchemist Abu Mussa Jahir Ibn Hayyan (721-815) wordt toegeschreven aan de introductie van de term antimoon om het element te benoemen.
Hij gebruikte de volgende etymologie: 'anti' als synoniem voor ontkenning, en alleen 'mono' voor. Toen wilde hij benadrukken dat de antimoon niet alleen van aard was. Het is al bekend dat het deel uitmaakt van zwavelmineralen, die net als andere elementen.
Het verkrijgen van
Men denkt dat de Griekse naturisten pedanius dialescorides puur antimoon verkrijgen, door antimoonsulfide te verwarmen in een luchtstroom. De Italiaanse metallurgische Vannocio Biringucio, in het Boek van Pyrotechnics (1540), maakt een beschrijving van een methode om het antimoon te isoleren.
De Duitse chemicus Andreas Libavius (1615), door het gebruik van een gegoten mengsel van ijzer, antimoon sulfide, zout en kaliumtartrato, bereikte de productie van een kristallijn antimoon.
Het eerste gedetailleerde rapport over het antimoon werd in 1707 gemaakt door de Franse chemicus Nicolas LeMery (1645-1715), in zijn boek behandeld op het antimoon.
Kan u van dienst zijn: koperchloride (i) (CUCL): structuur, eigenschappen, gebruikAntimoonstructuur
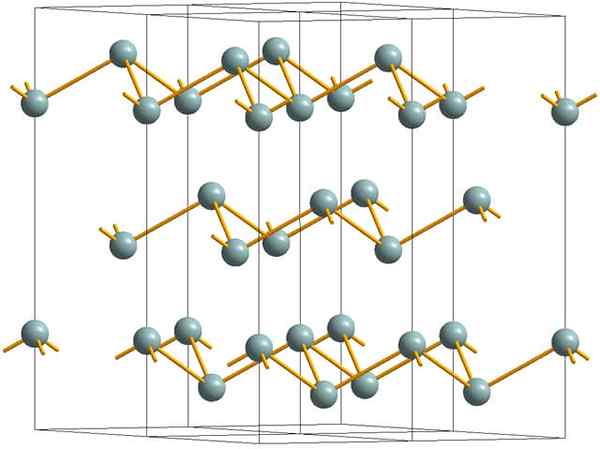 Gerimpelde lagen waaruit de kristallijne structuur bestaat van metalen of zilveren antimoon. Bron: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Gerimpelde lagen waaruit de kristallijne structuur bestaat van metalen of zilveren antimoon. Bron: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] De bovenste afbeelding toont de structuur van gerimpelde lagen die zijn aangenomen door arseenatomen. Grijsachtige antimoon, beter bekend als metallisch antimoon, neemt deze structuur echter ook aan. Er wordt gezegd dat het "gerimpeld" is omdat er SB -atomen zijn die uit het vliegtuig stijgen en vallen die uit de laag zijn samengesteld.
Deze lagen, hoewel ze verantwoordelijk zijn voor de fotonen die ermee omgaan om zilveren glitters te laten glanzen, waardoor het antimoon als een metaal is, is de waarheid dat de krachten die hen verenigen zwak zijn; Van hier naar de schijnbare metalen fragmenten van SB kunnen gemakkelijk worden getoond en zijn bros of sneakers.
Bovendien zijn SB -atomen in gerimpelde lagen niet voldoende om hun atomaire orbitalen te groeperen en zo een band te creëren die elektrische geleiding mogelijk maakt.
Als je een grijsfeer afzonderlijk ziet, kun je zien dat het drie SB-SB-links heeft. Vanuit een hoger vlak was de SB te zien in het midden van een driehoek, met drie SB op zijn hoekpunten. De driehoek is echter niet plat en heeft twee niveaus of vloeren.
De laterale reproductie van dergelijke driehoeken en hun banden vestigt gerimpelde lagen, die zijn uitgelijnd om rhomboebische kristallen te vormen.
Stoffen
De nieuw beschreven structuur komt overeen met het grijsachtige antimoon, de meest stabiele van zijn vier alotropen. De andere drie alotropen (zwart, geel en explosief) zijn metastabiel; dat wil zeggen, ze kunnen bestaan onder zeer rigoureuze omstandigheden.
Er is niet al te veel informatie over de structuren. Het is echter bekend dat het zwarte antimoon amorf is, zodat de structuur rommelig en ingewikkeld is.
Het gele antimoon is stabiel onder -90 ° C, het gedraagt zich als een niet -metalen element en kan worden verondersteld dat bestaat uit kleine SB -agglomeraten4 (vergelijkbaar met fosfor); Wanneer het wordt verwarmd, verandert het in de zwarte alotroop.
En met betrekking tot het explosieve antimoon, bestaat het uit een gelatineuze tank gevormd op de kathode tijdens de elektrolyse van een waterige oplossing van een antimoonhalogenide.
Naar het minste sterke rubb.
Eigenschappen
Atoomgewicht
121,76 g/mol.
Atoomnummer
51.
Elektronische configuratie
[KR] 4D105s25 p3.
Oxidatietoestanden
-3, -2, -1, +1, +2, +3, +4, +5.
Fysieke beschrijving
Glanzend zilver, bros, placeous oppervlak, met een blauwe tint. Het kan ook verschijnen als een zwart stof.
Smeltpunt
630.63 ºC.
Kookpunt
1.635 ºC.
Dikte
-6.697 g/cm3 op kamertemperatuur.
-6.53 g/cm3 In vloeibare toestand, temperatuur gelijk aan of groter aan het smeltpunt.
Fusiewarmte
19.79 kJ/mol.
Verdampingswarmte
193.43 kJ/mol.
Kan u van dienst zijn: kopersulfide: structuur, eigenschappen, gebruikMolaire caloriecapaciteit
25.23 J/Mol.K
Elektronegativiteit
2.05 (Pauling Scale).
Atomaire radio
140 uur.
Hardheid
Het is een zacht element, met een hardheid van 3 op de MOHS -schaal en kan worden bekrast door glas.
Stabiliteit
Het is stabiel bij kamertemperatuur, geen oxidatie ervaren. Het is ook bestand tegen zure aanval.
Isotopen
Het heeft twee stabiele isotopen: 121SB en 123SB. Bovendien zijn er 35 radioactieve isotopen. De radioactieve isotoop 125SB is degene met de grootste helft -het leven: 2,75 jaar. Over het algemeen stoten radioactieve isotopen β -straling uit+ en β-.
Elektrische en thermische geleidbaarheid
Antimoon is een slechte geleider van warmte en elektriciteit.
Chemische reactiviteit
Kan de waterstof niet verplaatsen van verdunde zuren. Ionische complexe vorm met organische en anorganische zuren. Het metalen antimoon reageert niet met de lucht, maar het wordt snel omgezet in oxide in de natte lucht.
Halogenen en sulfiden oxideren gemakkelijk het antimoon, als het proces optreedt bij hoge temperaturen.
Toepassingen
Legeringen
Het antimoon wordt gebruikt in legering met lood voor de uitwerking van platen voor autobatterijen, waardoor de weerstand van de platen wordt verbeterd, evenals de kenmerken van de belastingen.
Lood en tinlegering is gebruikt om de kenmerken van de lassen te verbeteren, evenals die van de tracer -kogels en cartridges. Het wordt ook gebruikt in legeringen voor elektrische kabelcoating.
Het antimoon wordt gebruikt in antifriction -legeringen, bij de bereiding van peel- en verhardende legeringen met een laag tin -gehalte bij de vervaardiging van organen en andere muziekinstrumenten.
Het presenteert het kenmerk, gedeeld met het water, van toenemend volume wanneer gecondenseerd; Dus het antimoon dat aanwezig is in legeringen met lood en tin, vult alle ruimtes van de mallen en verbetert de definitie van de structuren gemaakt met deze legeringen.
Brandweer
Antimoon trioxide wordt gebruikt voor de uitwerking van ontstekingsverbindingen, altijd in combinatie met gehalogeneerde brandvertragers, bromuros en chloride.
Brandvertragers kunnen reageren met zuurstof- en radicale atomen OH, wat vuur remt. Deze igniphed worden gebruikt in kleding voor kinderen, speelgoed, vliegtuigen en in autostoelen.
Ze worden ook toegevoegd in polyesterharsen, en in glazen vezelbereiding voor gebruikte items zoals lichte vliegtuigmotoren dekken.
Antimoonverbindingen die worden gebruikt als brandvertragers omvatten: antimoon oxychloride, SBOCL; antimoon pentoxide, sbo5; Antimoon trichloride, sbcl3; en antimoon trioxide, SBO3.
Elektronica -veld
Het wordt gebruikt bij de productie van halfgeleiders, diodes, middelste infrarooddetectoren en bij de uitwerking van transitors. High Purity Antimony, gebruikt in halfgeleidertechnologie, wordt verkregen door de reductie van antimoonverbindingen met waterstof.
Kan u van dienst zijn: factoren die de oplosbaarheid beïnvloedenGeneeskunde en veterinair
Antimoonverbindingen worden in de geneeskunde gebruikt sinds de oudheid zoals Eméticas en Antiprotozoa. Kaliumkaliumtartrato (esthetisch wijnsteen) werd lange tijd als antisquisosomaal gebruikt; Ook gebruikt als slijmoplossend, diaforetisch en Emético.
Antimoonzouten zijn ook gebruikt bij de conditionering van de huid van herkauwersdieren; zoals aniomaline, en lithium en antimoon tiomalaat.
Meglumine -antimoon is een medicijn dat wordt gebruikt bij de behandeling van leishmaniasis in externe schijnwerpers van huisdieren. Hoewel, de therapeutische voordelen waren schaars.
Pigmenten en schilderijen
Antimoonverbindingen worden gebruikt bij de uitwerking van verf en opacifier in emaille. Ze worden ook gebruikt in Bermellón, gele en oranje pigmenten, die producten zijn van langzame oxidatie van antimoonsulfiden.
Sommige van zijn organische zouten (Tartratos) worden in de textielindustrie gebruikt om te helpen bij de link van bepaalde kleurstoffen.
Antimoon sulfide werd in het oude Egypte gebruikt als cosmetisch in het donker worden van de ogen.
Andere gebruiken
Sommige antimoonzouten worden gebruikt als coatingmiddelen om microscopische bubbels te elimineren die op televisieschermen worden gevormd. Antimoonionen interageren met zuurstof, waardoor hun neiging om bubbels te vormen elimineren.
Antimoon sulfide (III) wordt gebruikt in de hoofden van sommige beveiligingswedstrijden. Antimony sulfide wordt ook gebruikt bij de stabilisatie van de wrijvingscoëfficiënt van de materialen die worden gebruikt in autoremblokken.
De isotoop 124SB, samen met beryllium, wordt gebruikt als een bron van neutronen, met een energiegemiddelde van 24 keV. Bovendien wordt antimoon gebruikt als katalysator in de productie van kunststoffen.
Risico's
Het is een bros element, zodat een poeder van verontreinigende stoffen van de omgeving kan optreden tijdens manipulatie. Bij werknemers die worden blootgesteld aan antimoonstof, dermatitis, renitis, ontsteking van hoog luchtwegen en conjunctivitis is waargenomen.
Pneumoconiose is beschreven, soms gecombineerd met obstructieve longveranderingen, na langdurige tentoonstellingen.
Antimoon trioxide kan schade veroorzaken aan hartfunctioneren die sterfelijk kan zijn.
Bij mensen die aan dit element worden blootgesteld, is de aanwezigheid van pustulaire huidinfecties waargenomen, van een voorbijgaande aard.
Continue lage dosisinname van dit metaal kan diarree braken en maagzweren veroorzaken. Ook is de maximaal aanvaardbare concentratie in de lucht 0,5 mg/m3.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- veel. (11 maart 2009). Geel antimoon en explosief antimoon. Opgehaald uit: AntimonyProperties.Blogspot.com
- Profit. Ernst Cohen en J. C. Van den Bosch. (1914). De allotropie van antimoon. Procedings Royal Acad. Amsterdam. Vol. Xvii.
- Wikipedia. (2019). Antimoon. Opgehaald uit: in.Wikipedia.borg
- Advameg, Inc. (2019). Antimoon. Hersteld van: chemiexplaed.com
- Mc'oneale sabel. (15 september 2018). Chemie: eigenschappen en toepassing van SB-antimonie. Hersteld van: medium.com
- « Biogeografie geschiedenis, welke studies en onderzoeksvoorbeelden
- Auditieve vervuiling veroorzaakt, gevolgen, oplossingen »

