Amines

- 2768
- 613
- Ernesto McKenzie
Wat zijn de amines?
De amines Het zijn organische verbindingen afgeleid van ammoniak. Daarin zijn er covalente vakbonden tussen koolstof en stikstof. Natuurlijk is het stikstofmolecuul kinetisch inert; Maar dankzij biologische fixatie wordt het ammoniak, wat op zijn beurt lijdt aan latere alkyleringsreacties.
Wanneer de ammoniak wordt "gehuurd", vervangt deze een, twee of drie van zijn drie hydrogenen door koolstofatomen. Deze koolstofatomen komen misschien af van een huurgroep (R) of aryl (AR). Er zijn dus alifatische amines (lineair of vertakt) en aromatisch.
De amines zijn sterkere organische bases dan dezelfde ammoniak. Ze zijn gemakkelijk te verwijderen uit plantaardige materie en hebben over het algemeen sterke interacties met de neuronale matrix van organismen; Daarom bestaan veel medicijnen en medicijnen uit amines met complexe structuren en substituenten.
Aminestructuur
 Algemene formule voor een amine. Bron: Mache, Wikimedia Commons.
Algemene formule voor een amine. Bron: Mache, Wikimedia Commons. Hoewel het varieert, afhankelijk van de aard van R, is de elektronische omgeving van het stikstofatoom voor allemaal hetzelfde: Tetraëdral. Maar met een paar elektronen die niet worden gedeeld op het stikstofatoom (··), wordt de moleculaire geometrie piramidaal. Dit is zo met ammoniak en amines.
Aminas kan worden weergegeven met een tetraëder, evenals zoals het wordt gedaan met koolstofverbindingen. Dus NH3 en ch4 Ze worden getekend als tetraëderra, waar het paar (··) zich bevindt in een van de hoekpunten boven stikstof.
Beide moleculen zijn aquiraal; Ze beginnen echter chiraliteit te presenteren als hun H vervangt. De amina r2NH is aquiraal als de twee r verschillend zijn. Het mist echter elke configuratie om een enantiomeer van een ander te onderscheiden (zoals het gebeurt met de chirale koolstofcentra).
Dit komt omdat de enantiomeren:
R2N-H | H-NR2
Ze worden uitgewisseld met een snelheid zodat geen van beide kan worden geïsoleerd; en daarom worden de structuren van de amines beschouwd als aquiralen, zelfs wanneer alle substituenten in het stikstofatoom verschillend zijn.
Amine -eigenschappen
Polariteit
De amines zijn polaire verbindingen, sinds de amino NH -groep2, Voor het hebben van een atoom van electonegatieve stikstof, draagt het bij aan het dipoolmoment van het molecuul. Merk op dat stikstof de capaciteit heeft om waterstofbindingen te doneren, die over het algemeen hoog kook- en fusiepunten hebben.
Fysieke eigenschappen
In de wereld van de chemie ontstaat, wanneer het over een amine is, de onvrijwillige daad van het bedekken van zijn neus. Dit komt omdat ze in het algemeen meestal onaangename geuren hebben, waarvan sommige lijken op die van rotte vis.
Het kan u van dienst zijn: Maillard -reactieBovendien hebben vloeibare amines meestal geelachtige tinten, die het visuele wantrouwen dat ze genereren vergroten.
Oplosbaarheid in water
De amines zijn meestal onoplosbaar in water, omdat, ondanks dat ze in staat zijn om waterstofbruggen met de H₂o te vormen, de meerderheid van organische component hydrofoob is. Hoe meer omvangrijk of lang de R -groepen, hoe minder hun oplosbaarheid in water zal zijn.
Wanneer er echter een zuur in het midden is, wordt de oplosbaarheid verhoogd door de vorming van wat bekend staat als aminezouten. Daarin heeft stikstof een positieve gedeeltelijke belasting, die elektrostátisch aantrekken naar het anion- of zuurconjugaatbasis.
Basiciteit
Amines zijn sterkere organische bases dan ammoniak. Hoe groter de elektronische dichtheid rond het stikstofatoom, hoe eenvoudiger het zal zijn; dat wil zeggen, de zuren van het medium zullen sneller ontrennen. Als het amine erg basic is, kan het zelfs het proton uit de alcoholen pakken.
Types (primair, secundair, tertiair)
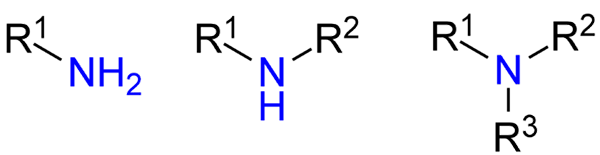 Soorten amines. Bron: Jü via Wikipedia.
Soorten amines. Bron: Jü via Wikipedia. Hoewel ze niet formeel zijn gepresenteerd, is verwezen naar primaire, secundaire en tertiaire amines (bovenste afbeelding, van links naar rechts).
Primaire amines (RNH2) zijn monosustuidas; De secundaire (r2NH), worden opgelost, met twee ralcomile of arylgroepen; en het tertiair (r3N), zijn trisustuidid en mist waterstof.
Alle bestaande amines zijn afgeleid van deze drie typen, dus hun diversiteit en interacties met de biologische en neuronale matrix zijn enorm.
Over het algemeen kan worden verwacht dat tertiaire amines de meest elementaire zijn; Een dergelijke verklaring kan echter niet worden afgelegd zonder de structuren van R te kennen.
Vorming van amines
Ammoniakalkylering
In eerste instantie werd vermeld dat amines afkomstig zijn van ammoniak; Daarom is de eenvoudigste manier om ze te vormen door hun alkylering. Om dit te doen, wordt een overmaat ammoniak gereageerd met een alkylhalide, gevolgd door de toevoeging van een basis om het aminezout te neutraliseren:
NH3 + Rx => rnh3+X- => Rnh2
Merk op dat deze stappen leiden tot een primaire amina. Secundaire en zelfs tertiaire amines kunnen ook worden gevormd, dus de prestaties voor een enkel product nemen af.
Sommige trainingsmethoden, zoals de synthese van Gabriel, staan toe om primaire amines te verkrijgen, zodat andere ongewenste producten niet worden gevormd.
Kan u van dienst zijn: Ethylalcohol: structuur, eigenschappen, gebruik, verkrijgenEvenzo kunnen ketonen en aldehyden worden verminderd in aanwezigheid van ammoniak en primaire amines, om aanleiding te geven tot secundaire en tertiaire amines.
Katalytische hydrogenering
Nitroverbindingen kunnen worden verminderd in aanwezigheid van waterstof en een katalysator om te transformeren in hun overeenkomstige amines.
Arno2 => Rnah2
De nitrilos, rc≡N en de amidas, rconr2, Ze worden ook verminderd om respectievelijk primaire en tertiaire amines te geven.
Nomenclatuur
Hoe worden de amines genoemd? Meestal worden ze genoemd volgens R, de Aquilo of Aryl Group. Aan de naam van R, afgeleid van zijn alkane, wordt het woord 'amine' uiteindelijk aan hem toegevoegd.
Dus ch3Ch2Ch2NH2 Het is propilamine. Aan de andere kant kan het alleen worden aangesteld als de alkane en niet als een R -groep: propanamine.
De eerste manier om ze te benoemen is zo veel bekend en gebruikt.
Als er twee NH -groepen zijn2, De alkane wordt benoemd en de posities van de aminogroepen worden vermeld. Dus h2NCH2Ch2Ch2Ch2NH2 Het wordt genoemd: 1.4-butanodiamine.
Als er geoxygeneerde groepen zijn, zoals OH, moet prioriteit worden gegeven aan NH2, die wordt benoemd als een substituent. Bijvoorbeeld hoch2Ch2Ch2NH2 wordt genoemd: 3-aminopropanol.
En met betrekking tot secundaire en tertiaire amines zijn de N -letters gemaakt om de R -groepen aan te geven. De langste ketting zal de naam van de compound behouden. Dus cho3NHCH2Ch3 Het wordt genoemd: n-methylethylamine.
Gebruik van amines
Kleurstoffen
Primaire aromatische amines kunnen dienen als een uitgangsmateriaal voor de synthese van azo -kleurstoffen. Aanvankelijk reageren de amines op diazoniumzouten, die de verbindingen vormen door dakcopulatie (of diazoïsche koppeling).
Vanwege de intense van de kleuring worden ze in de textielindustrie gebruikt als vervenmateriaal; Bijvoorbeeld: methyloranje, bruin 138 Directe, gele zonsondergang FCF en Ponceau.
Drugs en drugs
Veel medicijnen werken met agonisten en antagonisten van natuurlijke amine -neurotransmitters. Voorbeelden:
-Chloorfeniramine is een antihistamine dat wordt gebruikt bij de controle van allergische processen vanwege de inname van sommige voedingsmiddelen, hooikoorts, insectenstam, enz.
-Chloorpromazine is een kalmerend middel, geen slaapinductor. Het verlicht angst en wordt zelfs gebruikt bij de behandeling van sommige psychische stoornissen.
-Efedrine en fenymphedrine worden gebruikt als decongestanten van de luchtwegen.
Kan u van dienst zijn: osmolariteit-Amitriptaline en imipramine zijn tertiaire amines die worden gebruikt bij de behandeling van depressie. Tricyclische antidepressiva worden geclassificeerd door hun structuur.
-Opioïde analgetica zoals morfine, codeline en heroïne zijn tertiaire amines.
Gasbehandeling
Verschillende amines, waaronder diglycolamine (DGA) en Dietolamine (DEA), worden gebruikt bij de eliminatie van koolstofdioxidegassen (CO2) en waterstofsulfide (h2S) aanwezig in aardgas en raffinaderijen.
Landbouwchemie
Metilamines zijn intermediaire verbindingen in de synthese van chemicaliën die in de landbouw worden gebruikt, zoals herbiciden, fungiciden, insecticiden en biociden.
Harsen Manufacturing
Metilamines worden gebruikt tijdens de uitwerking van ionenuitwisselingsharsen, bruikbaar in waterdeionisatie.
Dierlijke voedingsstoffen
Trimethylamine (TMA) wordt voornamelijk gebruikt bij de productie van chloridechloride, een vitamine B -supplement dat wordt gebruikt bij kippen, kalkoenen en varkens.
Rubberindustrie
De dimethylamine (DMA) olie is een emulgator voor gebruik in synthetische rubberproductie. DMA wordt direct gebruikt als een polymerisatiemodificator in de stoomfase van de butadieen, en als een stabilisator van de natuurlijke rubberen latex in plaats van de ammoniak
Oplosmiddelen
Dimethylamine (DMA) en monomethylamine (MMA) worden gebruikt om timethylformamide polaire polaire oplosmiddelen (DMF), dimethylacetamide (DMAC) en N-methylpirrolidon (NMP) (NMP) te synthetiseren (NMP) (NMP).
Onder DMF -toepassingen zijn onder meer: urethaancoating, acrylgarenoplosmiddel, reactielolventen en extractie -oplosmiddelen.
DMAC wordt gebruikt bij de productie van kleurstoffen en garenoplosmiddel. Ten slotte wordt NMP gebruikt bij het raffineren van smeerolie, pick -up en emailcoating.
Voorbeelden van amines
Cocaïne
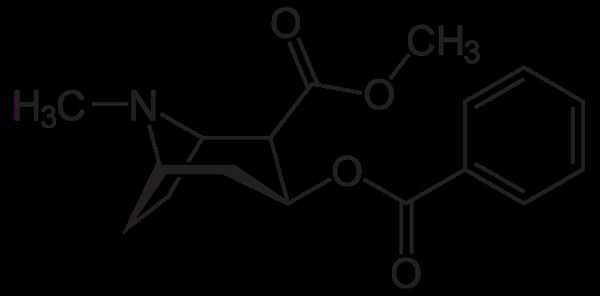 Cocaïnemolecuul. Neurotokeker, Wikimedia Commons
Cocaïnemolecuul. Neurotokeker, Wikimedia Commons Cocaïne wordt gebruikt als een lokale verdoving in bepaalde soorten oogchirurgie, oren en keel. Zoals gezien, is het een tertiaire amine.
Nicotine
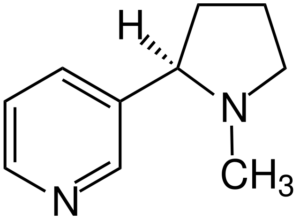 Nicotinemolecuul. Bron: Jü [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)], van Wikimedia Commons
Nicotinemolecuul. Bron: Jü [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)], van Wikimedia Commons Nicotine is het primaire middel van tabaksverslaving en chemisch een tertiaire amine. De nicotine aanwezig in de tabaksrook wordt snel geabsorbeerd en is zeer giftig.
Morfine
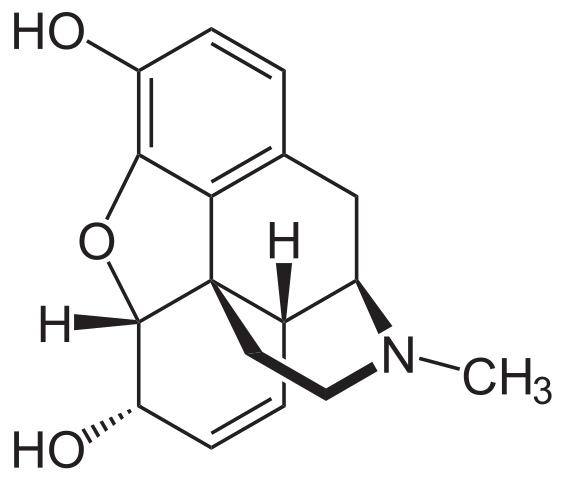 Morfinemolecuul. Bron: Neurotoger [Public Domain], van Wikimedia Commons
Morfinemolecuul. Bron: Neurotoger [Public Domain], van Wikimedia Commons Het is een van de meest effectieve analgetica om pijn te verlichten, vooral kanker. Het is nogmaals een tertiaire amine.
Serotonine
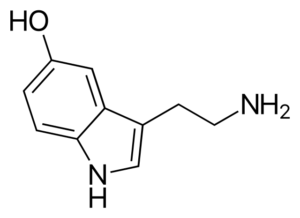 Serotoninemolecuul. Bron: Harbin [Public Domain], van Wikimedia Commons
Serotoninemolecuul. Bron: Harbin [Public Domain], van Wikimedia Commons Serotonine is een amine neurotransmitter. Bij depressieve patiënten is de concentratie van de hoofdmetaboliet van serotonine verlaagd. In tegenstelling tot de andere amines is dit primair.
Referenties
- Methylamines: gebruik en toepassingen. Hersteld van: chemours.com
- Transparant marktonderzoek. (S.F.)). Amines: belangrijke feiten en toepassingen. Hersteld van: TransparencyMarketResearch.com

