Alanina -kenmerken, structuur, functies, biosynthese
- 5081
- 991
- Lonnie Rohan
De aan het meisje (Wing) is een van de 22 bekende aminozuren die de structuur vormen van de eiwitten van alle organismen, van bacteriën tot mannen. Omdat het organisme kan synthetiseren, wordt dit geclassificeerd als een niet -essentieel aminozuur.
Eiwitten hebben een basis- of primaire structuur die bestaat uit een aminozuurketen genaamd polypeptideketen, in die ketens wordt elk aminozuur gevormd door een centrale koolstof die koolstof α wordt genoemd.
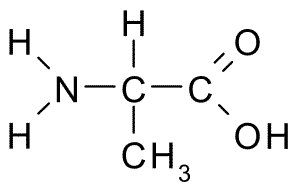
 Chemische structuur van alanine -aminozuur (Bron: Borb, via Wikimedia Commons)
Chemische structuur van alanine -aminozuur (Bron: Borb, via Wikimedia Commons) De α-koolstof sluit zich aan bij vier groepen: een aminogroep (-NH2), een carboxylgroep (-coh), een waterstofatoom (-H) en een groep of zijketen (-r) die elk aminozuur identificeert. In de zijketen nemen koolstoffen achtereenvolgens de letters ß, γ, δ en ε in.
Aminozuren worden geclassificeerd door de polariteit van hun zijketens en dus zijn er hydrofobe en hydrofiele polaire aminozuren die op hun beurt neutraal, basic en zuur kunnen zijn. Alanine is een hydrofoob apolair aminozuur en is het eenvoudigste aminozuur na glycine en de meest voorkomende in de meeste eiwitten.
Alanine kan in de spier worden gevormd en naar de lever worden getransporteerd, waar het wordt geïntroduceerd naar de gluconeogene route, dat wil zeggen de route voor glucosevorming van niet -glucosidische stoffen. Alanine kan ook in de lever worden gesynthetiseerd door het katabolisme van tryptofaan en uracil en kunnen afbreken om pyruvaat te vormen.
Deelnemen aan de synthese van tryptofaan, pyridoxine (vitamine B6) en vlees.
Het wordt gebruikt als een voedingssupplement om de sportprestaties te verbeteren en wordt van nature aangetroffen in koe-, varkensvlees- en visvlees, evenals in melk en hun derivaten en eieren. Sommige peulvruchten, fruit en noten zijn ook rijk aan alanine.
[TOC]
Structuur
Eerder werd opgemerkt dat alanine, net als alle aminozuren, een α-koolstof heeft met vier groepen verenigd, als de R-groep A-methylgroep (-CH3).
Daarom, naar de pH van het lichaam (rond 7.4) De a-koolstof van de alanine is gekoppeld aan een amino-protongroep (-NH3+), met een carboxylgroep die een proton (-co-) heeft verloren, aan een waterstof en een methylgroep (-CH3).
De meeste aminozuren zijn ioniseerbaar tot pH 7.0 en geometrisch kunnen ze isomeren hebben, die bekend staan als enantiomeren, die spiegelende beelden zijn, zoals bij de rechter- en linkerhand.
Kan u dienen: Histochemistry: Foundation, Processing, StingingVervolgens kunnen alle aminozuren worden gevonden als "chirale paren" aangeduid als D of L (respectievelijk Dextro en Levo), volgens de positie van de atomen rond koolstof α.
Alanine, zoals bij het meeste aminozuur.
Dit aminozuur kan ook worden gevonden als β-alanine, waarin de aminogroep is bevestigd aan zijn β-koolstof, dat wil zeggen aan de eerste koolstof van zijn zijketen.
Β-alanine wordt gevonden in pantoteninezuur (vitamine B5) en in sommige natuurlijke peptiden. D-alanine wordt gevonden in sommige polypeptiden die deel uitmaken van de wanden van sommige bacteriële cellen.
Groep R (Metilo, CH3))
De methyl van de alanine -zijketen is een verzadigde koolwaterstof die het apolaire hydrofobe kenmerk aan dit aminozuur geeft. Dit kenmerk van alanine is gebruikelijk bij de andere aminozuren van deze groep zoals glycine, valine, leucine en isoleucine.
De aminozuren die de groep alifatisch vormen, zijn chemisch neutrale aminozuren en spelen een zeer belangrijke rol bij de vorming en het onderhoud van de drie -dimensionale structuur van eiwitten, omdat ze de neiging hebben om op elkaar te reageren met elkaar uitsluitend het water.
Deze aminozuren, waaronder alanine, bevatten hetzelfde aantal ioniseerbare groepen met tegengestelde belastingen, dus ze hebben geen netto belasting en worden "genoemd"Zwitterions ".
Functie
Als de meeste bekende aminozuren wordt alanine gebruikt bij de synthese van peptiden en eiwitten in het algemeen, en neemt deel aan de oprichting van de polypeptidestructuur en in de tertiaire structuur van sommige eiwitten.
Een andere van de belangrijke functies van alanine is om indirect deel te nemen aan Glycemia -controle:
Het kan aanleiding geven tot pyruvaat en vice versa, het kan ook de lever bereiken en glucose worden door gluconeogenese om te worden gespot op circulatie of om te worden gebruikt in glycogeensynthese, indien nodig als nodig.
Alanine neemt deel als een ammoniumtransporter van de spier naar de lever, omdat deze kan worden gesynthetiseerd door aminatie door pyruvaat, het transporteren van de lever en er is transaminatie door transaminatie.
Dit gebeurt gelijktijdig met de transformatie van a-zotoglutaraat naar glutamaat, die de ureumcyclus kan betreden en pyruvaat kan worden.
Andere functies
Dit aminozuur is onmisbaar voor de synthese van tryptofaan en pyridoxine. Hoewel het chemisch heel weinig reactief is, kan alanine een herkenning van substraat en enzymatische regulatieherkenning hebben.
Kan u van dienst zijn: parafiletische groepEen van de functies van β-alanine is die van voedingssupplement, omdat het wordt gebruikt als een ergogene hulp van de oefening. De β-alanine-inname verhoogt de concentratie van vlezig (een dipéptide gevormd door β-alanine en histidine) in de skeletspier, die werkt als "buffer".
Normaal gesproken draagt vlezig niet aanzienlijk bij aan de totale buffercapaciteit van de spiercel en dit is te wijten aan de lage concentratie. De toediening van β-alanine verhoogt deze concentratie en dus de buffercapaciteit, dus het verbetert de weerstand door vermoeidheid te verminderen.
Biosynthese
De belangrijkste synthese van alanine in het menselijk lichaam vindt plaats door een reductieve aminatie van pyruvinezuur. Deze reactie vereist een enkele enzymatische stap.
Het pyruvaat biedt het koolstofskelet en het glutamaat biedt de aminogroep die naar het pyruvaat wordt overgebracht. Het enzym dat deze omkeerbare reactie katalyseert, is de transaminase -alanine.
Als gevolg van deze reactie worden alanine en a-cetoglutaraat geproduceerd. Alanine kan dan aanwezig zijn in gluconeogenese, glycolyse en in de Krebs -cyclus.
Een andere bron van alanine komt van de afbraak van de tryptofaan tot acetyl-CoA. Op deze route, wanneer het quinureninase-enzymhydrolyseert bij de 3-hydroxi quinurenine wordt gevormd 3-hydroxy antranilaat en alanine. Alanine wordt vrijgegeven en het 3-hydroxy-antranilaat volgt de metabole route.
Uracil -afbraak is een andere bron van alanine. In dit geval is er β-alanine die verschillende metabole paden kan volgen, een daarvan is om acetyl-CoA te worden.
Degradatie
Algemeen proces van afbraak van aminozuur
Aminozuren worden niet opgeslagen als koolhydraten en vetten, dus die die worden vrijgegeven tijdens eiwitafbraak moeten worden hergebruikt voor de synthese van nieuwe eiwitten en nucleotiden.
Aan de andere kant kunnen aminozuren worden afgebroken en kunnen hun koolzuurhoudende skeletten worden gebruikt in katabole of anabole reacties.
Wanneer aminozuren worden afgebroken, is overtollige stikstof ammoniakvorm, die een giftige stof is die moet worden geëlimineerd en de eerste stap van afbraak van aminozuur is de eliminatie van stikstof.
Bij zoogdieren vindt deze afbraak plaats in de lever; Daar wordt al het aminozuur dat niet kan worden gebruikt, afgebroken.
Alanine -afbraak
Alanine -afbraak vindt plaats door de omzetting van alanine in pyruvaat. Deze reactie wordt gekatalyseerd door transaminase-alanine en vereist de aanwezigheid van a-zotoglutaraat als een acceptor van de aminogroep en de daaropvolgende glutamaatvorming; Het is een omkeerbare reactie.
Kan u van dienst zijn: virulentiefactorenDeze alaninevormingsreacties van pyruvaat en alanine -afbraak om pyruvaat te vormen, maken deel uit van een cyclus die skeletspier en lever omvat.
De lever neemt glucose naar spier en spieren, door glycolyse, zet glucose om in pyruvaat om ATP te genereren; Dit pyruvaat kan de synthese van alanine invoeren, die in de bloedsomloopstroom kan worden gegoten en terugkeert naar de lever die het opnieuw pyruvaat maakt, dat gluconeogenese binnenkomt om glucose te vormen.
Indien nodig wordt de cyclus herhaald. In de lever genereert de productie van pyruvaat uit alanine ammoniumionen die naar glutamine en glutamaat kijken en ze komen de ureumcyclus binnen. Dan wordt het ureum geëlimineerd door urine.
Alanine, glycine, cysteïne, serine en tronine zijn glycogene aminozuren, omdat hun afbraak aanleiding kan geven tot pyruvaat, a-zetoglutaraat, succinyl-coa, om te fumaraat of oxalacetaat, alle gluconeogene precursoren van glucose van glucose van glucose van glucose van glucose van glucose, allemaal gluconeic.
Voedsel rijk aan Alanina
De belangrijkste bronnen van aminozuren zijn mager vlees, vis, schaaldieren, eieren en zuivelproducten, maar alanine wordt ook gevonden in veel voedingsmiddelen van plantaardige oorsprong. Voorbeeld van voedingsmiddelen die rijk zijn aan Alanina zijn:
- Vlees zoals koe, varkensvlees, schapen, kip, kalkoen, konijn, vis; Eieren, melk en derivaten.
- Droog fruit zoals hazelnoten, noten, kastanjes, amandelen en pinda's zijn Alanina -bronnen.
- Kokosnoot, avocado, asperges, aubergine, cassave of cassave, bieten, wortel en zoete aardappelen.
- Peulvruchten zoals maïs, bonen en erwten.
- Granen zoals rijst, rogge, tarwe, cacao, haver en rogge.
Referenties
- Caruso, J., Charles, J., Unruh, K., Giebel, r., Larmonth, L., & Potter, W. (2012). Ergogene effecten van β-alanine en carnosine: voorgesteld toekomstig onderzoek om efficacy te kwantificeren. Voedingsstoffen, 4(7), 585-601.
- Gille, c., Bölling, c., Hoppe, a., Bulik, s., Hoffmann, s., Hübner, k.,… Holzhütter, h. G. (2010). Hepatonet1: een uitgebreide metabole reconstructie van de menselijke hepatocyten voor de analyse van leverfysiologie. Molecular Systems Biology, 6(411), 1-13.
- Mathews, c., Van Holde, K., & Ahern, k. (2000). Biochemie (3e ed.)). San Francisco, Californië: Pearson.
- Murray, r., Bender, D., Botham, k., Kennelly, p., Rodwell, V., & Weil, p. (2009). Harper's geïllustreerde biochemie (28e ed.)). McGraw-Hill Medical.
- Nelson, D. L., & Cox, m. M. (2009). Lehninger -principes van biochemie. Omega -edities (5e ed.)).
- « Elektromagnetische vervuiling veroorzaakt, gevolgen
- Glutaminezuurkenmerken, functies, biosynthese »

