Agar Lia (Iron Lysina) Wat is, fundering, voorbereiding, gebruik
- 5071
- 1553
- Nathan Wiegand
Hij Agar Lia (Iron Lysina) Het is een biochemische test die wordt gebruikt voor de identificatie van bacteriën van de familie Enterobacteriaceae. Dit medium is gemaakt door Edwards en Fife, gebaseerd op Falkow -formule.
Oorspronkelijk was deze test een bouillon met peptones, gistextract, glucose, l-lisin, bromocresh en gedistilleerd water paars. Edwards en Fife voegden agar-adagar, ijzerscitratus van ammonium- en natriumtiosulfaat toe.
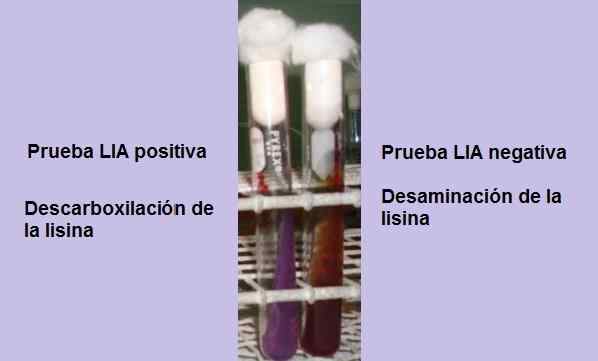
 Positieve en negatieve test van lysine -decarboxylering. Bron: foto en schema eigendom van de MSC -auteur. Marielsa Gil
Positieve en negatieve test van lysine -decarboxylering. Bron: foto en schema eigendom van de MSC -auteur. Marielsa Gil De test bestaat in principe uit het aantonen van de aanwezigheid van het enzym rudboxylase, in staat om te reageren met de carboxylgroep van het L-Lisin-aminozuur. Een deaminatie van het aminozuur kan ook optreden vanwege de aanwezigheid van het enzym lysine hartzeer.
Bovendien maakt de samenstelling van het medium het mogelijk om het vermogen van sommige bacteriële geslachten aan te tonen om waterstofsulfide te produceren. Ten slotte is het ook mogelijk om de generatie te observeren of niet van gas in het midden.
Basis
Peptonas en gist extract
Zoals de meeste gewasmedia bevat Lisine Iron Agar componenten die de nodige voedingsbron bieden voor bacteriegroei. Deze componenten worden weergegeven door peptones en gistextract.
Glucose
Evenzo bevat deze agar als fermenteerbare koolhydraatglucose. Het is bekend dat alle bacteriën van de familie Enterobacteriaceae de glucose gisten.
Deze stap is cruciaal, omdat het de leiding zal hebben over het verzachten van de omgeving, een onmisbare voorwaarde voor het enzym lysine decarboxylase - als het aanwezig is - werkt op zijn substraat.
In sommige bacteriële genres kan de gasproductie worden waargenomen door glucosefermentatie.
Het gas wordt bewezen wanneer een verplaatsing van de agar OCC.
Kan u van dienst zijn: biomaterialenL-Lisina
Zodra de lysine is gedecarboxyleerd, wordt een diamine (cadaverine) en koolstofanhydride gevormd.
Diskering vindt plaats in aanwezigheid van het pyridoxale fosfaatco -enzym. Deze reactie is onomkeerbaar.
PH -indicator (bromocresol paars)
Alle pH -veranderingen hebben in het midden plaatsgevonden door de verschillende reacties, worden gedetecteerd door de pH -pH -indicator van bromocresol.
In die zin, wanneer er verzuring is, wordt het medium geel, en wanneer er alkalisatie is, keert het medium terug naar de oorspronkelijke paarse of paarse kleur.
Wanneer Lysine's hartzeer optreedt vanwege de aanwezigheid van het enzymlysine, wordt een roodachtige kleur gevormd op het oppervlak, typisch in de proteus, de voorzienigheid en wat Morganella -soorten.
Dit is te wijten aan het feit dat tijdens het ontsmettingsproces alfa-zo-carbonzuur wordt gevormd, die reageert met ammoniumcitraat in aanwezigheid van zuurstof, wat de bovengenoemde kleur veroorzaakt.
IJzersterkte van ammonium- en natriumtiosulfaat
Aan de andere kant zullen bacteriën die waterstofsulfide produceren bewijs zijn2S.
De bacteriën met het verminderde thiosulfaat -enzym hebben het vermogen om te werken door het huidige natriumthiosulfaat te verminderen, sulfiet en waterstofsulfide te vormen (H2S).
De laatste is een kleurloos gas, maar bij het reageren met ijzerzout vormt metalen sulfide, wat een onoplosbare verbinding is (zichtbaar zwart neerslag).
De trainingscapaciteit van h echter2S met dit medium is niet erg betrouwbaar, omdat sommige negatieve decarboxylase -bacteriën in staat zijn om h te produceren2S zal niet het zwarte neerslag vormen, omdat de zuurgraad van het medium interfereert. Daarom wordt het aanbevolen om te bevestigen met andere middelen die ijzer bevatten.
Kan u van dienst zijn: neuronenInterpretatie van de test
Recboxylering van lysine
De buizen moeten worden gelezen na 24 uur incubatie, anders bestaat er een risico om de reactie te misverstelen, valse negatieven te melden.
Vergeet niet dat de eerste reactie die zal optreden de gisting van glucose is, daarom worden alle buizen na 10 tot 12 uur geel.
Als aan het einde van de incubatietijd (24 uur) een gele achtergrond is met een paars of paars oppervlak, is de reactie negatief. De paarse kleur van het oppervlak komt overeen met de alkalisatie van het medium door het gebruik van peptones.
Een positieve reactie is dat waar de bodem en het oppervlak van de buis volledig paars zijn, dat wil zeggen, het terugkeert naar de oorspronkelijke kleur.
Daarom, wie de positiviteit van de test bepaalt, is de basis of onderkant van het medium. Als u twijfelt over de kleur, kan deze worden vergeleken met een niet -geïnoculeerde Lia -buis.
Lysine -deaminatie
Een buis die het hartzeer van lysine laat zien, heeft een granaat roodachtig oppervlak en een gele achtergrond (zuur), of de hele granaat roodachtige buis.
Deze reactie wordt geïnterpreteerd als negatief voor de decarboxylering van de lysine, maar positief voor Lysina -deaminatie.
Deze reactie is gedefinieerd en geïnterpreteerd in de schuine wijze.
Waterstofsulfide -productie (h2S)
Een positieve reactie wordt waargenomen door het uiterlijk van een zwart neerslag in het midden of een deel ervan. In het algemeen tussen de liml van de ring en de basis.
Als het neerslag plaatsvindt in de buis, zal dit niet worden gezien.
Registratie van resultaten
Bij het interpreteren van de test worden de resultaten als volgt geregistreerd:
Kan u van dienst zijn: Miller en Urey ExperimentEerst wordt de ring gelezen, vervolgens de achtergrond of taco, dan de productie van h2S, en uiteindelijk gasproductie.
Voorbeeld: K/A + (-). Dit betekent:
- K: Alkalische ring (paarse kleur)
- A: Zure achtergrond (geel), dat wil zeggen negatieve decarboxyleringsreactie en negatief hartzeer.
- +: Productie van waterstofsulfide
- (-): zonder gas.
Voorbereiding
Weeg 35 gr van het liggende medium ijzer uitgedroogd en lost op in een liter gedestilleerd water.
Heet tot het de agar volledig oploste, om een minuut te kooken, zwaaiend vaak. Verdeel 4 ml van het medium in 13/100 testbuizen met katoenen deksel.
Steriliseer in autoclaaf bij 121 ° C gedurende 15 minuten. Verwijder uit de autoclaaf en laat de neiging staan, zodat er een diepe basis is en een korte afschuining.
Bewaar in een koelkast van 2-8 ° C. Laat een bacteriële stam temperatuur.
De kleur van het gedehydrateerde medium is beige en het voorbereide roodachtige paarse medium.
De uiteindelijke pH van het voorbereide medium is 6,7 ± 0.2
Het medium wordt geel met pH gelijk aan of minder dan 5,2 en is paars bij pH 6,5 omhoog.
Toepassingen
Deze test, samen met andere biochemische tests, wordt gebruikt voor de identificatie van bacillen van de familie Enterobacteriaceae.
Het medium wordt gezaaid met een rechte of naald, een of twee lekke banden worden op de bodem van de buis gemaakt en vervolgens stond het oppervlak van het medium in zigzag.
Het is 24 uur incuba bij 35-37 ° C bij aerobiose. Indien nodig wordt het nog 24 uur meer geïncubeerd.
Het is vooral handig voor het onderscheiden van negatieve Citrobacter -soorten van Salmonellas SP.
Referenties
- Mac Faddin J. (2003). Biochemische tests voor de identificatie van klinisch belang bacteriën. 3e ed. Pan -Amerikaans redactioneel. Buenos Aires. Argentinië.
- Forbes B, Sahm D, Weissfeld a. (2009). Bailey & Scott microbiologische diagnose. 12 ed. Pan -Amerikaanse redactionele s.NAAR. Argentinië.

