Natriumacetaatstructuur, eigenschappen, synthese, gebruik

- 2987
- 711
- James Dach
Hij natriumacetaat Het is een natriumzout van azijnzuur waarvan de moleculaire formule c is2H3OF2NA. Het bestaat uit een delicue wit poeder, in wezen aanwezig in twee vormen: watervrij en trihydraat. Beide zijn erg oplosbaar in water, het universele oplosmiddel; Maar niet zo oplosbaar in alcoholen of aceton.
De anhydra -vorm heeft een dichtheid, een fusie- en kookpunt met hogere waarden dan die gepresenteerd door de trihydraatvorm van natriumacetaat. Dit komt omdat watermoleculen interfereren tussen na -ioneninteracties+ en ch3Coo-.
 Natriumacetaat uiterlijk
Natriumacetaat uiterlijk Natriumacetaat is stabiel, vooral als het wordt opgeslagen tussen 2 en 8 ºC; Maar het is vatbaar voor de werking van sterke oxiderende middelen en halogenen.
Het kan worden bereid door de reactie van natriumbicarbonaat met azijnzuur. Ook met de reactie van azijnzuur met natriumhydroxide. Beide reacties zijn eenvoudig te naderen en lage economische kosten; De eerste kan zelfs thuis worden gedaan.
Dit zout is een beetje giftige verbinding. Produceert een irritatie van de huid, alleen na een frequent en continu contact. Het is weinig irritant voor de ogen, maar kan de luchtwegen irriteren. Er is geen informatie over een schadelijk effect van uw inname.
Het heeft talloze toepassingen en toepassingen, die de pH -dempingsfunctie benadrukken, samen met azijnzuur. De acetaatschokdemper heeft een PKA = 4.7; die een hoge efficiëntie verleent in de regulatie van de pH in een zure omgeving met pH -waarden tussen 3 en 6.
Vanwege de lage toxiciteit en zijn eigenschappen is het veel gebruikt om de smaak van voedsel te verbeteren, evenals een middel dat bescherming biedt tegen hun ontleding vanwege hun actie tegen microben.
[TOC]
Natriumacetaatstructuur
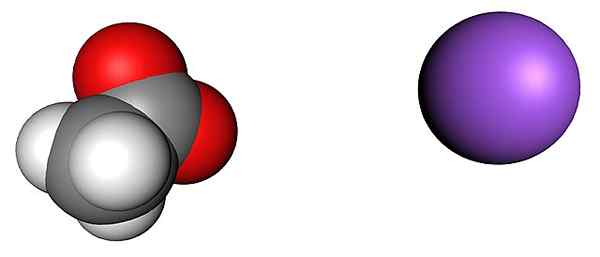 Acetaat- en natriumionen. Bron: SHU0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Acetaat- en natriumionen. Bron: SHU0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Het bovenste beeld toont de ionen die de watervrij natriumacetaatkristallen vormen (zonder water). De paarse bol komt overeen met het na -kation+, En het moleculaire ion aan zijn linkerkant is acetaat, cho3Coo-, Met zijn zuurstofatomen voorgesteld door rode bollen.
Deze leeftijdsgenoten, volgens de chip ch3Pad, bevinden zich in een 1: 1 aandeel; Voor elke cho3Coo-, Er moet een na -kation zijn+ aangetrokken door zijn negatieve belasting en vice versa. Dus attracties tussen hen, en afstotingen tussen gelijke belastingen, worden structurele patronen vastgesteld die een kristal definiëren, waarvan de minimale expressie de eenheidscel is.
Deze unitaire cel, net als het glas als geheel, varieert afhankelijk van de beschikking van de ionen in de ruimte; Het is niet altijd hetzelfde, zelfs niet voor hetzelfde kristallijne systeem. Anhydrous natriumacetaat kan bijvoorbeeld twee ortorrombische polymorfen vormen, waarvan eronder één hieronder wordt weergegeven:
 Eenheidscel van natriumacetaat orthorrombische kristallen. Bron: Benjah-bmm27 [Public Domain]
Eenheidscel van natriumacetaat orthorrombische kristallen. Bron: Benjah-bmm27 [Public Domain] Let op de opstelling van de ionen: vier cho ionen3Coo- Ze sluiten een NA in+ Op zo'n manier "tekenen" ze een vervormde vierkante basispiramide. Elk van deze Cho3Coo- interactie op zijn beurt met een andere NA+ aangrenzend.
Gehydrateerde kristallen
Natriumacetaat heeft veel affiniteit voor water; In feite is het heerlijk, dat wil zeggen, het behoudt vocht totdat het in hetzelfde is opgelost. Hoe groter het vocht, eerder is het "smelt". Dit komt omdat het zo is3Coo- Zoals NA+ Ze kunnen hydrateren, zichzelf omringen met watermoleculen die hun dipolen naar hun belastingen leiden (NA+ Oh2, Ch3Coo- HOH).
Kan u dienen: zilveren bromide (AGBR): structuur, eigenschappen en gebruikWanneer dit zout in het laboratorium of thuis wordt bereid, is het zo'n affiniteit voor water dat zelfs bij normale temperaturen al als hydraat wordt verkregen; de ch3Pata · 3H2OF. Hun kristallen houden niet op ortorrombisch te zijn en worden monoklinisch, omdat ze nu drie watermoleculen voor elk paar Cho opnemen3Coo- en NA+.
Eigenschappen
Namen
-Natriumacetaat.
-Natriumethanoaat (IUPAC).
Molaire massa
-Watervrij: 82.03 g/mol.
-Trihydrated: 136.03 g/mol.
Aspect
Delicuescent wit poeder.
Geur
Tot azijn wanneer hij wordt verwarmd tot ontleding.
Dikte
-Anhidro: 1, 528 g/cm3 bij 20 ºC.
-Trihydrated: 1,45 g/cm3 bij 20 ºC.
Smeltpunt
-Anhidro: 324 ºC (615 ºF, 597 K).
-Triohydraat: 58 ºC (136 ºF, 331 K).
Kookpunt
-Anhidro: 881.4 ºC (1.618,5 ºF, 1.154.5 K).
-Trihydraat: 122 ºC (252 ºF, 395 K). Het ontleedt.
Oplosbaarheid
In water
-Anhydro: 123,3 g/100 ml bij 20ºC.
-Trihydrated: 46,4 g/100 ml bij 20 ºC.
In methanol
16 g/100 g bij 15 ºC.
In ethanol
5.3 g/100 ml (trihydraat).
In aceton
0,5 g/kg bij 15 ° C.
Zuurgraad
PKA: 24 (20 ºC).
Basiciteit
PKB: 9.25. Hier is het duidelijk dat natriumacetaat een basiszout is omdat hij PKB minder moet hebben dan zijn PKA.
Brekingsindex (ηd)
1.464
Calorische capaciteit
-100.83 J/Mol · K (watervrij).
-229.9 J/Mol · K (TrihyDrado).
ontstekingspunt
Meer dan 250ºC.
Zelf -uitsluittemperatuur
600 ºC.
pH
8.9 (oplossing 0,1 m tot 25 ºC).
Stabiliteit
Stal. Onverenigbaar met sterke en halogeen oxiderende middelen. Vocht.
Reacties
Natriumacetaat kan een ester vormen door te reageren met een huurhalide; Bijvoorbeeld Bromoetano:
Ch3Poron +BRCH2Ch3 => Ch3Cooch2Ch3 + Nabr
Natriumacetaat is decarboxyla om methaan (pyrolyse) te vormen in aanwezigheid van NaOH:
Ch3Poon +NaOH => ch4 + NA2CO3
De reactie wordt gekatalyseerd door Cesio Sales.
Synthese
Natriumacetaat kan worden geproduceerd tegen lage kosten in het laboratorium door natriumbicarbonaat met azijnzuur te reageren:
Nahco3 + Ch3COOH => ch3Pad +h2CO3
Deze reactie gaat gepaard met de aanwezigheid in de oplossing van een intense bel, vanwege de ontleding van koolzuur in water en koolstofdioxide.
H2CO3 => H2Of +co2
Industrieel wordt natriumacetaat geproduceerd door reactie van azijnzuur met natriumhydroxide.
Ch3COOH +NaOH => ch3Pad +h2OF
Toepassingen
Thermische zakken
Natriumacetaat wordt gebruikt voor de productie van thermische zakken.
Aanvankelijk worden zoutkristallen opgelost in een volume water voor het bereiden van een oplossing die oververzadigd wordt.
Dan wordt de oplossing van een temperatuur groter dan 58 ºC verwarmd, wat het smeltpunt is. De oververzadigde oplossing bij kamertemperatuur is toegestaan om af te koelen en de vorming van kristallen wordt niet waargenomen; De oplossing is overchirp.
Kan u van dienst zijn: periodiek systeem, waar is het voorDe afwezigheid van kristallen wordt verklaard dat de vloeibare moleculen te rommelig zijn en geen gepaste richtlijnen hebben om de kristallisatietemperatuur te bereiken. De vloeistof bevindt zich in een metastabiele toestand, een staat van onbalans.
Geven. In het geval van thermische zakken wordt een mechanische bevestiging ingedrukt om de vloeistof te roeren en de vorming van kristallen te initiëren en de stolling van de trihydrated natriumacetaatoplossing.
Naarmate de kristallisatie optreedt, neemt de temperatuur toe. Trihydrated natriumacetaatkristallen verwerven het ijs uiterlijk, maar ze zijn heet, dus het wordt "hot ijs" genoemd.
Industriëlen
-Natriumacetaat wordt in de textielindustrie gebruikt als een bijtend in het weefselkleuringsproces
-Zwavelzuurafval neutraliseren
-Het heeft gebruik in katoenverwerking voor de uitwerking van katoenen pads, bruikbaar in persoonlijke reiniging en voor medische doeleinden
-Het wordt gebruikt in metalen beitsen, voorafgaand aan het chromen
-Samengewerkt zodat de vulkanisatie van chloropreen niet voorkomt in het productieproces van synthetische rubber
-Grijpt in bij de zuivering van glucose
-Het wordt gebruikt bij het bruinen van skins.
Medisch gebruik
Natriumacetaat maakt deel uit van de verbindingen die worden gebruikt om elektrolyten te leveren die worden toegediend aan intraveneus patiënten.
Het wordt gebruikt om de natriumniveaus te corrigeren bij hyponathemische patiënten, ook bij de correctie van metabole acidose en urine -alkalinatie.
PH -dempingoplossing
Het wordt gebruikt als een pH -regulator in veel enzymatische reacties die optreden tussen pH 3 en pH 6.
De verschillende pH van de acetaatbufferoplossing wordt bereikt door de variatie van de concentratie van azijnzuur en natriumacetaat.
Om bijvoorbeeld een pH 4,5 te verkrijgen, heeft de bufferoplossing een concentratie azijnzuur van 3,8 g/l en een concentratie van watervrij natriumacetaat van 3,0 g/l.
De concentratie van de acetaatbufferoplossing kan worden verhoogd, waardoor in dezelfde verhouding de componenten van de benodigde oplossing toeneemt om de gewenste pH te verkrijgen.
Acetaat/acetonitril schokdemper wordt gebruikt in capillaire elektroforese in fotoberberine scheiding.
Onderzoekslaboratoria
-Natriumacetaat is een zwak nucleofiel middel dat wordt gebruikt bij anionische polymerisatie van β-lacton.
-Het wordt gebruikt als een reagens in de nucleaire magnetische resonantie van biologische macromoleculen.
-Het wordt gebruikt bij de extractie van de cellen van de cellen. Natrium is een kation dat interageert met de negatieve ladingen van fosfaten aanwezig in DNA, wat helpt bij zijn condensatie. In aanwezigheid van ethanol vormt het DNA een neerslag dat vervolgens kan worden gescheiden in de waterige laag.
Voedselbehoud
-Het helpt de bacteriegroei te voorkomen, naast het voorkomen van het genereren van overtollige zuurgraad die voedselversiering veroorzaakt, waardoor een specifieke pH wordt gehandhaafd,.
-Het natrium aanwezig in acetaat verbetert de smaak van voedsel.
-Natriumacetaat wordt gebruikt bij de bereiding van groente -augurken: komkommer, wortel, ui, enz. Bovendien wordt het gebruikt in vleesbehoud.
Kan u dienen: dimethylanyline: structuur, eigenschappen, synthese, gebruikBehoud van beton
Het beton wordt beschadigd door de werking van water die zijn duur verkort. Natriumacetaat werkt als een betonafdichtingsmiddel dat het waterdicht is om water te geven, waardoor de initiële kenmerken worden verlengd.
Jonge experimenten
Experiment 1
Een eenvoudig experiment is natriumacetaatsynthese door de natriumbicarbonaatreactie met azijn (5%azijnzuur).
30 ml azijn worden in een beker geplaatst en er worden ongeveer 3,5 g bicarbonaat toegevoegd.
In de reactie wordt natrium- en koolstofzuurvormen gevormd. Zuur wordt opgesplitst in koolstofdioxide en water. Het genereren van koolstofdioxide zal een intense bel binnen de oplossing produceren.
Om natriumacetaat te verzamelen, wordt waterverdamping veroorzaakt, waardoor de oplossing wordt verwarmd.
Experiment 2
Een ander eenvoudig experiment is de vorming van natriumtrihydraatacetaat.
Om dit te doen, ongeveer 20 g natriumacetaattrihydraat en in een beker geplaatst, voegt vervolgens 10 ml water toe, en voegt vervolgens 10 ml water toe. De oplossing wordt verwarmd tot een temperatuur groter dan 58 ºC.
Natriumacetaat is volledig opgelost om ervoor te zorgen dat de oplossing oververzadigd is. Eerder werd een Pietri -capsule op een koud oppervlak geplaatst.
De inhoud van de beker met trihydraatacetaat in Pietri's capsule wordt langzaam gegoten. De vloeibare temperatuur in de capsule begint af te dalen, zelfs onder het smeltpunt, zonder de kristallisatie of stolling van het trihydraat natriumacetaat te observeren.
Meestal om de kristallisatie van trihydrated natriumacetaat te produceren, wordt een kleine hoeveelheid zout toegevoegd om te dienen als een kristallisatiekern. Andere keren is er een kleine verstoring van de oplossing om de kristallisatie van natriumacetaat te initiëren.
De trihydrated natriumacetaatkristallen lijken op het ijs, maar als ze worden aangeraakt, wordt opgemerkt dat ze relatief heet zijn. Om deze reden wordt zout "heet ijs" genoemd.
Toxiciteit
Natriumacetaat is een zeer weinig giftige verbinding. Het is ook niet geclassificeerd als een sensibilisator voor huid en luchtwegen.
Bovendien wordt natriumacetaat niet geclassificeerd als een mutagene middel in kiem, carcinogeen of toxische cellen voor reproductie.
Kortom, het is weinig irritant voor de ogen. De luchtwegen kunnen worden geïrriteerd na hun inademing. Frequent en constant contact met de huid kan de irritatie veroorzaken.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- WorldofChemicals. (16 januari 2017). Hoe u thuis natriumacetaat kunt bereiden? Hersteld van: medium.com
- Nationaal centrum voor biotechnologie -informatie. (2019). Natriumacetaat. PubChem -database. CID = 517045. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- S. Cameron, K. M. Mannan en M. OF. Rahman. (1976). De kristalstructuur van natriumacetaattrihydraat. Cryst Act. B32, 87.
- Wikipedia. (2019). Natriumacetaat. Opgehaald uit: in.Wikipedia.borg
- Helmestine, Anne Marie, pH.D. (24 januari 2019). Maak heet ijs van azijn en bakpoeder. Hersteld van: Thoughtco.com
- Chemisch boek. (2017). Natriumacetaat. Hersteld van: chemisch boek.com
- Wasserman Robin. (2019). Gebruik van natriumacetaat. Hersteld van: livestrong.com
- Drugsbank. (2019). Natriumacetaat. Hersteld van: Drugsbank.AC

