Isoamilo -structuur, eigenschappen, synthese en gebruik acetaat

- 1887
- 276
- Ernesto McKenzie
Hij Isoamilo acetaat Het is een ester waarvan de moleculaire formule cho is3COO (Ch2))2CH (Ch3))2. Bij kamertemperatuur bestaat het uit een olieachtige, heldere, kleurloze, brandbare en vluchtige vloeistof. In feite is het een te vluchtige en geurige ester.
Het belangrijkste kenmerk is afscheid te nemen van een geur die bijdraagt aan het aroma van veel fruit, vooral dat van bananen of banaan. Ook vormt deze laatste vrucht een van zijn natuurlijke bronnen bij uitstek.
 Bananen, wiens karakteristieke aroma te wijten is aan isoamilo -acetaat. Bron: Pixabay.
Bananen, wiens karakteristieke aroma te wijten is aan isoamilo -acetaat. Bron: Pixabay. Van daaruit de naam van bananenolie die wordt gegeven aan een isoamilacetaatoplossing, of een mengsel van isomylacetaat met nitrocellulose. De verbinding wordt veel gebruikt als een smaak van voedsel, ijs en snoep.
Bovendien wordt het gebruikt bij de uitwerking van geuren met verschillende banen. Het is ook een oplosmiddel dat wordt gebruikt bij de extractie van metalen en organische verbindingen zoals azijnzuur.
Isoamilo -acetaat is het resultaat van de sterificatie van isoamylalcohol met azijnzuur. In de laboratoria van de organische chemie is deze synthese een interessante ervaring om de verestering te implementeren, terwijl het laboratorium overspoelt met bananengeur.
[TOC]
Isoamilo -acetaatstructuur
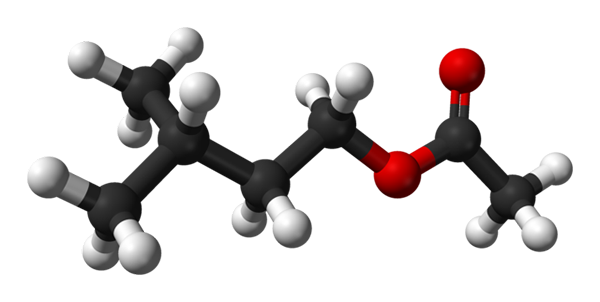 Isoamilo -acetaatstructuur. Bron: Ben Mills [Public Domain]
Isoamilo -acetaatstructuur. Bron: Ben Mills [Public Domain] In het bovenste beeld heb je de moleculaire structuur van het isoamilacetaat door middel van een bollen en barsmodel. De rode bollen komen overeen met zuurstofatomen, met name die die deze verbinding identificeren als een ester; Het gedeelte van ether, r-o-r, en de carbonylgroep, c = o, en hebben dan de structurele formule r'Koor.
Links, r', Je hebt de isopentiel alkyglische radicaal, (cho3))2Chch2Ch2; En rechts, r, aan de methylgroep, waaraan de 'acetaat' van de naam van deze ester verschuldigd is. Het is een relatief kleine ester, in staat om te interageren met de chemische receptoren van de geur van onze neus, waardoor signalen worden veroorzaakt die de hersenen interpreteren als een geur.
Kan u van dienst zijn: vertakte alkanesIntermoleculaire interacties
Het isoamilacetaatmolecuul zelf is flexibel; Maar het isopentielradicaal komt niet ten goede aan intermoleculaire interacties omdat het wordt vertakt, waardoor zuurstofatomen sterisch worden voorkomen om efficiënt te interageren door dipool-dipolo-krachten.
Ook kunnen deze twee zuurstof geen waterstofbruggen accepteren; Structureel heeft het molecuul niet hoe ze ze kunnen doneren. Geconfronteerd met de onderbroken dipolen, kan isoamilacetaat intermoleculair interageren door dispersietroepen in Londen; die recht evenredig zijn met hun moleculaire massa.
Het is dus de moleculaire massa van de ester die verantwoordelijk is voor zijn moleculen om een vloeistof te vormen met een hoog kookpunt (141 ° C). Evenzo is het verantwoordelijk voor zijn vaste dekking tot een temperatuur van -78 ° C.
Bananengeur
De intermoleculaire krachten zijn zo zwak, dat de vloeistof vluchtig genoeg is om zijn omgeving te doordringen met bananengeuren. Interessant is dat de zoete geur van deze ester kan veranderen als het aantal koolstofatomen wordt verminderd of verhoogd.
Dat wil zeggen, als in plaats van zes alifatische koolstofatomen te hebben, hij vijf (met de radicale isobutil) had, zou zijn geur lijken op die van frambozen; Als de radicale de secbutil zou zijn, zou de geur worden geladen met sporen van organische oplosmiddelen; En als ik meer dan zes koolstofatomen had, zou de geur zeep en metaal worden beginnen te worden.
Eigenschappen
Chemische namen
-Isoamilo acetaat
-Isopentiel ethanoaat
-3-methylbutilo acetaat
-Isopentilo acetaat
-Bananenolie of banaan.
Moleculaire formule
C7H14OF2 of ch3COO (Ch2))2CH (Ch3))2
Molecuulgewicht
130,187 g/mol.
Fysieke beschrijving
Het is een vette, heldere en kleurloze vloeistof.
Geur
Bij kamertemperatuur heeft het een intense en aangename geur van banaan.
Smaak
Het heeft een smaak die vergelijkbaar is met die gepresenteerd door de peer en appel.
Kookpunt
124.5 ºC.
Smeltpunt
-78,5 ºC.
ontstekingspunt
92 ºF gesloten beker (33 ºC); Kopje open 100 ºF (38 ºC).
Kan u van dienst zijn: kristallijne vaste stoffen: structuur, eigenschappen, typen, voorbeeldenOplosbaarheid in water
2.000 mg/l A 25 ºC.
Oplosbaarheid in biologische oplosmiddelen
Mengbaar met alcohol, ether, ethylacetaat en amylalcohol.
Dikte
0,876 g/cm3.
Dampdichtheid
4.49 (in luchtrelatie = 1).
Dampdruk
5,6 mmHg bij 25 ºC.
Zelf -uitsluittemperatuur
680 ºF (360 ºC).
Smurrie
-1.03 cpoise bij 8,97 ºC
-0.872 cpoise op 19,91 ºC.
Verbranding warmte
8.000 limoen/g.
Geurdrempel
Lucht = 0,025 µl/l
Water = 0,017 mg/l.
Brekingsindex
1.400 tot 20 ° C.
Relatieve verdampingssnelheid
0,42 (in relatie tot butylacetaat = 1).
Dialectric constant
4.72 tot 20 ºC.
Opslag
Isoamilo -acetaat is een ontvlambare en vluchtige verbinding. Daarom moet het koud zijn in volledig hermetische containers, verre van brandbare stoffen.
Synthese
Het wordt geproduceerd door de verestering van isoamylalcohol met ijsazijn, in een proces dat bekend staat als Fisher's Estterification. Zwavelzuur wordt meestal gebruikt als katalysator, maar ook p-toluenosulfonzuur katalyseert de reactie:
(Ch3))2CH-CH2-Ch2Ch2OH + CH3COOH => ch3Cooch2-Ch2-Ch2-CH (Ch3))2
Toepassingen
Food and Drink Smaken
Het wordt gebruikt om een perensmaak te verlenen aan water en siropen. Het wordt in China gebruikt om fruitsmaken te bereiden, zoals aardbei, bramen, ananas, peer, appel, druif en banaan. De gebruikte doses zijn: 190 mg/kg in zoetwaren; 120 mg/kg in deeg; 56 mg/kg in ijs; en 28 mg/kg in frisdranken.
Oplosmiddel en verdunningsmiddel
Het is een oplosmiddel voor:
-Nitrocellulose en celluloid
-Waterdichte vernissen
-Rubber
-Vinylhars
-Cummarona hars en ricinusolie.
Het wordt gebruikt als een oplosmiddel voor chroombepaling en wordt gebruikt als een ijzer-, kobalt- en nikkel -extractiemiddel. Het wordt ook gebruikt als een oplosmiddel van olieverfschilderijen en oude lakken. Bovendien wordt het gebruikt bij de uitwerking van nagellak.
Deze ester wordt gebruikt als een verdunningsmiddel in de productie van azijnzuur. Olie wordt gebruikt als grondstof in een oxidatieproces dat een waterige oplossing van azijnzuur en andere verbindingen produceert, zoals mierenzuur en propionzuur.
Kan u dienen: Ethyleenglycol: eigenschappen, chemische structuur, gebruikAls oplosmiddel en drager van andere stoffen werd het aan het begin van de luchtvaartindustrie gebruikt om de stoffen tegen de luchtvleugels te beschermen.
Geuren
-Het wordt gebruikt als een sfeer om de slechte geuren te verbergen.
-Het wordt gebruikt als een parfum in schoenen.
-Om de efficiëntie van antigase -maskers te bewijzen, omdat isoamilacetaat een zeer lage geurdrempel heeft en niet erg giftig is.
-Het wordt gebruikt in geuren zoals Chipre; het zachte aroma Osmanthus; De Jacinto; en de sterke oosterse smaak, gebruikt in lage doses, lager dan 1%.
Anderen
Het wordt gebruikt bij de uitwerking van zijde en kunstmatige parels, fotografische films, waterdichte en bronzende vernissen. Het wordt ook gebruikt in de textielindustrie bij het verven en afmaken. Het wordt gebruikt bij het droog wassen van kledingartikelen en stoffen meubels.
Bovendien wordt isoamilo -acetaat gebruikt in de uitwerking van Rayon, een synthetische stof; In penicilline -extractie, en als standaard chromatografie -substantie.
Risico's
Isoamilo -acetaat kan de huid en ogen irriteren door fysiek contact. Inademing kan neusirritatie, keel en longen veroorzaken. Ondertussen kan blootstelling aan hoge concentraties hoofdpijn, slaperigheid, duizeligheid, duizeligheid, vermoeidheid en flauwvallen veroorzaken.
Langdurig contact met de huid kan de droogheid en barsten veroorzaken.
Referenties
- Bilbrey Jenna. (30 juli 2014). Isoamylacetaat. Chemistry World door de Royal Society of Chemistry. Hersteld van: chemieworld.com
- Nationaal centrum voor biotechnologie -informatie. (2019). Isoamylacetaat. PubChem -database. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Isoamylacetaat. Opgehaald uit: in.Wikipedia.borg
- Royal Society of Chemistry. (2015). Isoamylacetaat. Chem. Hersteld van: Chemspider.com
- New Jersey Department of Health and Senior Services. (2005). Isoamylacetaat. [PDF]. Hersteld van: nj.Gov
- Chemisch boek. (2017). Isoamylacetaat. Hersteld van: chemisch boek.com
- « 4 periodes van chemie van prehistorie tot vandaag
- Politieke spraakkenmerken, soorten, kwesties en voorbeelden »

