Chrome -oxide (III) structuur, nomenclatuur, eigenschappen, gebruik

- 3297
- 384
- Dr. Rickey Hudson
Hij Chrome -oxide (III) U -chroomoxide is een anorganische groene vaste stof die wordt gevormd door het verbranden van chroommetaal (CR) in zuurstof (of2), waardoor Chrome met oxidatietoestand 3 achterblijft 3+. De chemische formule is CR2OF3. In de natuur wordt het gevonden in het Mineral van Eskolaíta. Natuurlijke afzettingen van chroomoxide (III) zijn niet bekend.
Het kan onder andere worden voorbereid door CR te verwarmen2OF3 gehydrateerd (Cr2OF3.NH2O) Om water volledig te verwijderen. Het wordt ook verkregen als een product van chroomoxide calcinatie (VI) (CRO3)).
 Chrome -oxidepigment (III). FK1954 [Public Domain]. Bron: Wikipedia Commons
Chrome -oxidepigment (III). FK1954 [Public Domain]. Bron: Wikipedia Commons De beste manier om het puur te verkrijgen is echter door ontleding van het ammoniumdichromaat (NH4))2Cr2OF7 bij 200 ºC. Industrieel wordt geproduceerd door vermindering van natriumdichromaat (NA2Cr2OF7) vast met zwavel.
Wanneer het fijn verdeeld is, presenteert het een felgroene kleur met geelachtige nuance. Maar als de deeltjes groter zijn, vertoont het een blauwachtige kleurstof. Chromisch oxide is het meest stabiele groene pigment dat bekend is. De thermische en chemische weerstand maakt het een waardevolle keramische kleurstof.
Het wordt gebruikt in industriële coatings, vernis, in de bouwsector, in sieraden, als een kleuring in cosmetica of in farmaceutische producten, naast andere toepassingen.
[TOC]
Structuur
Α-CR-oxide2OF3 Het heeft de structuur van het Corindon -type. Het kristallijne systeem is rhomboon hexagonaal. Is isomorf met α-alumina en a-fe2OF3.
De Eskolaíta, natuurlijk mineraal van chroomoxide (III), presenteert de hieronder getoonde structuur:
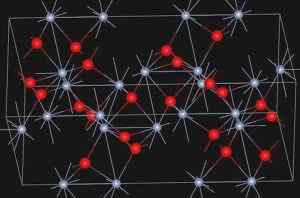 Kristalstructuur van Eskolaíta Mineral. https: // upload.Wikimedia.org/wikipedia/commons/e/ee/eskolaite_structure.JPG. Bron: Wikipedia Commons
Kristalstructuur van Eskolaíta Mineral. https: // upload.Wikimedia.org/wikipedia/commons/e/ee/eskolaite_structure.JPG. Bron: Wikipedia Commons Nomenclatuur
- Chrome -oxide (III).
- Groen chroomoxide.
- Dichroma -trioxide.
- Chroom zeegezeexide.
- Chromia.
- Eskolaíta: Chrome Oxide Mineral (III).
- Hydrateren: Cr2OF3.NH2Of (waarbij n ≅ 2) chroomoxide -hydraat (III) of Guignet Green wordt genoemd.
 Chrome -oxidehydraat (III). W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikipedia Commons
Chrome -oxidehydraat (III). W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikipedia Commons Eigenschappen
Fysieke staat
Kristallijne vaste stof.
Mohs hardheid
9 (hun kristallen zijn extreem moeilijk).
Molecuulgewicht
151,99 g/mol.
Kan u van dienst zijn: Quaternaire verbindingen: kenmerken, training, voorbeeldenSmeltpunt
Smelt bij 2435 ºC, maar het begint te verdampen tot 2000 ºC die wolken van groene rook vormen.
Dikte
5.22 g/cm3
Oplosbaarheid
Wanneer het bij hoge temperaturen is verwarmd, is het praktisch onoplosbaar in water (3 microgram/L bij 20 ° C); onoplosbaar in alcoholen en aceton; enigszins oplosbaar in zuren en alkalis; perchloorzuur gesmolten (HCLO4) tot 70%, waarin het kapot gaat.
pH
6.
Brekingsindex
2.551.
Andere eigenschappen
- Als het sterk wordt gecalcineerd, wordt het inert in de richting van zuren en basen. Anders de CR2OF3 en zijn gehydrateerde vorm Cr2OF3.NH2O Ze zijn amfoterisch, lost gemakkelijk op in zuur om aqua -ionen te geven [Cr (H2OF)6]3+, en in geconcentreerde alkali om "chromito's" te vormen.
- Wanneer het gecalcineerd is, is het chemisch resistent tegen zuren, alkalis en hoge temperaturen. Is extreem stabiel voor zo2.
- Het heeft een uitstekende weerstand tegen licht omdat zijn kristallen dekking, hoge UV -verzwakking en transparantie hebben voor zichtbaar licht.
- Het is een extreem hard materiaal, je kunt kwarts, tapacio en zirkonio krassen.
- Zijn hydraat CR2OF3.NH2Of (waarbij n ≅ 2) geen thermische stabiliteit heeft, beperkt het hydratatiewater zijn toepasbaarheid tot minder dan 260 ºC. Het presenteert een lage vervencapaciteit en beperkte nuance van nuances.
- Maar deze hydraat heeft een zeer schone en felgroen-blauwe tint. Het is semi -transparant, presenteert een lage dekking, uitstekende weerstand tegen licht en weerstand tegen alkalis.
- De Cr2OF3 Het is niet geclassificeerd als gevaarlijk materiaal en wordt beschouwd als een inerte fijn poeder. Het is niet onderworpen aan internationale transportvoorschriften.
- Irriteert de huid of slijmvliezen niet.
Toepassingen
In de keramische en glazen industrie
Vanwege zijn hoge weerstand tegen warmte en chemische weerstand, de CR2OF3 Gecalcineerd wordt gebruikt als een kleurplatform of gevesteerbaar pigment in keramische productie, in porseleinen email en mengsels voor glas.
In industriële coatings
Keramiek met chroomoxide (III) biedt uitstekende weerstand tegen de meeste corrosieve omgevingen. Dit alles door het uitsluitingsmechanisme van het omliggende substraat.
Om deze reden wordt het gebruikt in coatings om te voorkomen dat de corrosie van veel materialen, wordt toegepast door thermische spray (versterking of hete dauw).
Kan u van dienst zijn: chemisch proces: principes, typen, voorbeeldenHet wordt ook gebruikt als bescherming tegen schurende slijtage (wanneer de verwijdering van het materiaal wordt veroorzaakt door deeltjes die door een oppervlak bewegen).
In deze gevallen is de toepassing van een CR -coating2OF3 Door afzetting met plasma genereert het een hoge slijtvastheid.
De vorige twee gevallen hebben bijvoorbeeld hulpprogramma's in gasturospaciale turbinemotoren.
In de refractaire industrie
Het wordt gebruikt in thermisch en chemisch resistente bakstenen, coatingmaterialen en aluminiumoxide gebaseerd vuurvast beton.
In aanbouw
Omdat het uiterst bestand is tegen atmosferische omstandigheden, licht en warmte, wordt het aangebracht als een gekranuleerde rotskleurstof voor asfaltdaken, betoncement, industriële coatings van hoge kwaliteit voor exterieur, stalen constructies en gevelscoating (emulseerbare verven).
Als pigment in gevarieerde toepassingen
Het kan vulcanisatie -omstandigheden ondersteunen en wordt niet afgebroken, dus wordt het gebruikt in rubberpigmentatie.
Omdat ze niet-technisch zijn, wordt het gebruikt als een pigment voor speelgoed, cosmetica (vooral de hydraat), kunststoffen, printinkten, schilderijen die in contact komen met voedsel en farmaceutische producten.
In de pigmentindustrie wordt het gebruikt als grondstof om doordringende kleurstoffen te produceren die chroom en pigmenten bevatten op basis van fasen van gemengde metaaloxiden. Het wordt ook gebruikt als een kleur van schilderijen voor spoelcoating.
Het hydraat heeft een transparantie die de formulering van polychromatische afwerkingen in de auto -industrie mogelijk maakt (metallic auto -afwerkingen).
Vanwege het unieke kenmerk van het reflecteren van infraroodstraling (IR) vergelijkbaar met planten chlorofyl, lijkt het onder infraroodlicht gebladerte. Om deze reden is het gebruik ervan in camouflage -schilderijen of coatings voor militaire toepassingen zeer wijdverbreid.
In sieraden
Het wordt gebruikt als een kleurstof van synthetische edelstenen. Wanneer CR wordt geïntroduceerd2OF3 als onzuiverheid in het kristallijne netwerk van α-al2OF3, Net als in het halfwaardige Ruby Mineral is de kleur rood in plaats van groen.
Het wordt ook gebruikt als een slijpmiddel en gepolijst voor hoge hardheid en schurende eigenschappen.
Op chemische reacties
Ondersteund in aluminiumoxide (tot2OF3) of andere oxiden, wordt in organische chemie gebruikt als katalysator, bijvoorbeeld bij de hydrogenering van esters of aldehyden om alcoholen en bij koolwaterstofcyclisatie te vormen. Katalyseert de reactie van stikstof (n2) met waterstof (h2) Om ammoniak te vormen (NH3)).
Het kan u van dienst zijn: Lithium: geschiedenis, structuur, eigenschappen, risico's en gebruikVoor zijn oxide-reductiecapaciteit dat samen met chroomoxide (VI) werkt, speelt het een belangrijke rol in de dehydrogenering van alkanen2 Om propeno en isobuteen te produceren, omdat de cyclus van de kattendeactiveringscyclus gemakkelijk uitvoerbaar is. Het wordt ook gebruikt als katalysator in anorganische chemie.
In Chrome Manufacturing
Het wordt gebruikt in pure chroom metaalaluminothermproductie. Om dit te doen, moet het worden verwarmd tot 1000 ºC om de korrelgrootte te vergroten.
 Chrome metaalbereiding door aluminotherme reductie van chroomoxide (III). Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikipedia Commons
Chrome metaalbereiding door aluminotherme reductie van chroomoxide (III). Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikipedia Commons In magnetische materialen
Het is in kleine hoeveelheden toegevoegd aan magnetische materialen van audio- en videobanden door een zelf -indrukwekkend effect aan geluidshoofden te onderwijzen.
Recente innovaties
Het is verkregen pigmenten die de reflectie hebben verbeterd van bijna naar Dopar Cr nanodeeltjes gaan2OF3 met zouten van elementen die tot de zeldzame aardgroep behoren, zoals de lantano en de praseodimio.
Het verhogen van de concentratie van deze elementen neemt de zonne -reflectie van de bijna infrarood toe zonder de groene kleur van de CR -varken te beïnvloeden2OF3.
Hierdoor kan CR classificeren2OF3 Doping als "koud" pigment, omdat het geschikt is voor het regelen van warmte -accumulatie.
Toegepast op plafonds, auto's en bekleding, onder andere, bereikt een hoge reflectie van IR -zonlicht, waardoor we de warmteverhoging van omgevingen aanzienlijk kunnen verminderen.
Referenties
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Kirk-othmer (1994). Encyclopedie van chemische technologie. Deel 19. Vierde druk. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). VIJFDE EDITIE. Deel A7 en A20. VCH VerlagSgellschaft MBH.
- Amerikaanse elementen. (2019). Chroom (III) oxide. Hersteld van Amerikanen.com.
- Nationale bibliotheek van geneeskunde. (2019). Chroom (III) oxide. Hersteld van: pubchem.NCBI.NLM.NIH.Gov.
- Dorfman, Mitchell R. (2012). Thermische spuitcoatings. In Handbook of Environmental Degradation of Materials. Hoofdstuk 19. Hersteld van Scientedirect.com.
- Takehira, K. et al. (2004). CO2 Dehydrogenering van propaan over CR-MCM-41 katalysator. In studies in oppervlaktewetenschap en katalyse 153. Hersteld van Scientedirect.com.
- Selvam Sangeetha et al. (2012). Functionele pigmenten van chroom (III) nanodeeltjesoxide. Kleurstoffen en pigmenten 94 (2012) 548-552. Hersteld van Scientedirect.com.
- « Uaeh geschiedenis en betekenisschild
- Titanium geschiedenis, structuur, eigenschappen, reacties, gebruik »

