Berylliumoxide (bijeo)
- 1359
- 116
- Dewey Powlowski
 Chemische structuur van beryloxide
Chemische structuur van beryloxide Wat is Beryl Oxide?
Hij berylliumoxide (Beeo) is een keramisch materiaal dat, naast zijn hoge sterkte en elektrische weerstand, een warmtegeleidingscapaciteit heeft die zo hoog is dat een deel van kernreactoren maakt, zelfs overtroffen metalen in deze laatste eigenschap.
Naast het nut ervan als synthetisch materiaal, kan het ook in de natuur worden gevonden, hoewel het zeldzaam is. Het management moet zorgvuldig worden uitgevoerd, omdat het de capaciteit heeft om de gezondheid van mensen ernstig te beschadigen.
In de moderne wereld is waargenomen hoe wetenschappers geassocieerd met technologiebedrijven onderzoek hebben gedaan om geavanceerde materialen te ontwikkelen voor vrij gespecialiseerde toepassingen, zoals die die voldoen aan halfgeleidersmaterialen en die van de ruimtevaartindustrie.
Het resultaat hiervan is de ontdekking van stoffen die, dankzij de uiterst nuttige eigenschappen en hun hoge duurzaamheid, ons de mogelijkheid hebben gegeven om in de loop van de tijd vooruit te gaan, waardoor we onze technologie naar hogere niveaus kunnen brengen.
Chemische structuur van beryloxide
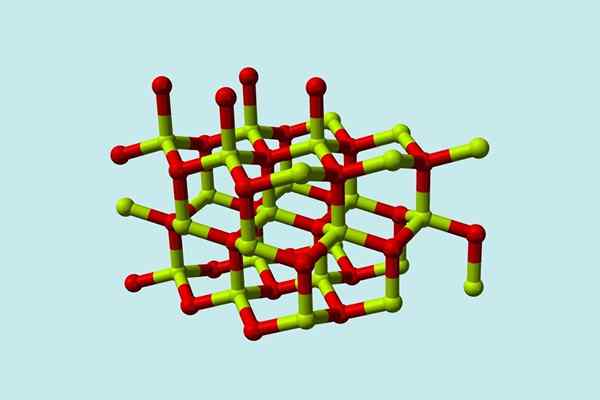
Een beryl -oxidemolecuul (ook wel genoemd Berilia) Het bestaat uit een atoom van beryllium en een van zuurstof, beide gecoördineerd in tetraëdrische oriëntatie, en kristalliseert in zeshoekige kristallijne structuren genaamd Wurtzitas.
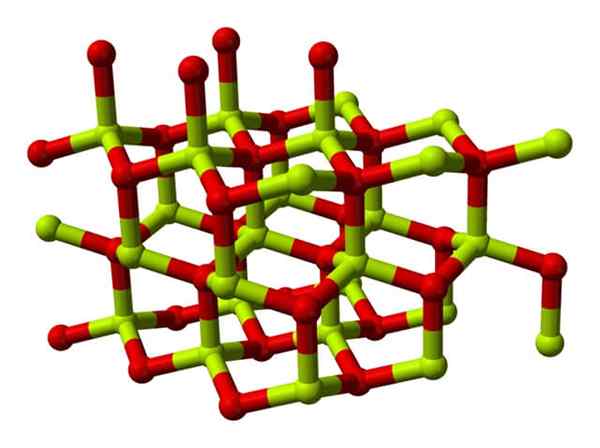 Model van de kristallijne structuur van beryloxide. Bron: Wikimedia Commons
Model van de kristallijne structuur van beryloxide. Bron: Wikimedia Commons Deze kristallen hebben tetraëdrische centra, die worden bezet door be2+ I2-. Bij hoge temperaturen wordt de structuur van berylliumoxide het tetragonale type.
Het verkrijgen van beryloxide wordt bereikt door drie methoden: beryl koolstofcalcinatie, uitdroging van berylhydroxide, of door de ontsteking van metaalberyllium. Het berylliumoxide gevormd bij hoge temperaturen is inert, maar kan worden opgelost door verschillende verbindingen.
Kan u van dienst zijn: chlorogeenzuurBeco3 + Verwarm → bijen + co2 (Calcinatie)
Be (oh)2 → Beeo + H2O (uitdroging)
2 be + of2 → 2 Beeo (ontsteking)
Ten slotte kan berylliumoxide worden verdampt en in deze toestand zal het worden gepresenteerd in de vorm van diatomaire moleculen.
Baarmoederoxide -eigenschappen
Berylliumoxide wordt in de natuur gepresenteerd als een bromellita, een wit mineraal dat wordt aangetroffen in sommige complexe mangaan-hydrero-afzettingen, maar wordt vaker gevonden in zijn synthetische vorm: een witte amorfe vaste stof die optreedt in stofvorm.
Ook zullen onzuiverheden die tijdens de productie zijn gevangen, verschillende kleuren geven aan het oxidemonster.
Het smeltpunt bevindt zich in 2.507º C, het kookpunt in 3.900º C, en heeft een dichtheid van 3,01 g/cm3.
Evenzo is de chemische stabiliteit aanzienlijk hoog en reageert alleen met waterdamp bij temperaturen in de buurt van 1.000º C, en kan bestand zijn tegen koolstofreductieprocessen en aanvallen op gesmolten metalen bij hoge temperaturen.
Bovendien is de mechanische weerstand behoorlijk en kan ze worden verbeterd met ontwerpen en adequate productie voor commercieel gebruik.
Elektrische geleidbaarheid
Berylliumoxide is een extreem stabiel keramisch materiaal en heeft daarom een vrij hoge elektrische weerstand die het een van de beste elektrische isolatiematerialen maakt, samen met aluminiumoxide.
Daarom wordt het vaak gebruikt voor hoogfrequente gespecialiseerde elektrische apparatuur.
Warmtegeleiding
Berylliumoxide heeft een groot voordeel in zijn thermische geleidbaarheid: het staat bekend als het tweede beste warmtegeleidend materiaal onder niet -metalen, alleen overwonnen door diamant, een aanzienlijk duurder en zeldzaam materiaal.
Kan u van dienst zijn: ThiolesWat betreft metalen, alleen koper en zilver geven beter warmte door te rijden dan berylliumoxide, waardoor het een zeer wenselijk materiaal is.
Vanwege de uitstekende warmtegeleidigenschappen is deze stof betrokken bij de productie van refractaire materialen.
Optische eigenschappen
Vanwege dezelfde kristallijne eigenschappen wordt berylliumoxide gebruikt voor de toepassing van transparant materiaal op ultraviolet in bepaalde platte schermen en fotovoltaïsche cellen.
Evenzo kunnen kristallen van zeer hoge kwaliteit optreden, dus deze eigenschappen verbeteren volgens het gebruikte productieproces.
Gezondheids risico's
Berylliumoxide is een verbinding die met grote zorg moet worden gemanipuleerd, omdat het voor het eerst carcinogene eigenschappen heeft, die zijn gekoppeld aan de continue inhalatie van poeders of dampen van dit materiaal.
Kleine deeltjes in deze fasen van oxide hechten zich aan de longen en kunnen de vorming van tumoren of een ziekte genereren die bekend staat als belliose.
Berilaiosis is een ziekte met een gemiddelde sterftecijfer die inefficiënte ademhaling, hoest, gewichtsverlies en koorts en de vorming van granulomen in de longen of andere aangetaste organen veroorzaakt.
Er zijn ook gevaren om contact van het berylliumoxide met de huid te sturen, omdat het corrosief en irritant is en kan schade aan het huidoppervlak en de slijmvlies veroorzaken. Ademhalingswegen en handen moeten worden beschermd bij het werken met dit materiaal, vooral in hun stofvorm.
Berylliumoxide -gebruik
Het gebruik van beryloxide is voornamelijk verdeeld in drie: elektronische toepassingen, nucleair en andere.
Kan u van dienst zijn: wat is de erristeneo?Elektronische toepassingen
Het vermogen om warmte over te brengen naar een hoog niveau en zijn goede elektrische weerstand heeft het Beleril -oxide een groot nut als thermische dissipator laten verwerven.
Het gebruik ervan in circuits in computers met hoge capaciteit is aangetoond, naast apparatuur die hoge elektriciteitsstromen verwerkt.
Berylliumoxide is transparant voor x -reeks en microgolf, dus het wordt in de vensters gebruikt tegen dit soort straling, naast antennes, communicatiesystemen en magnetronovens.
Nucleaire toepassingen
Zijn vermogen om neutronen te matigen en hun structuur te behouden onder stralingsbombard.
Andere apps
De lage dichtheid van berylliumoxide heeft belangstelling voor de ruimtevaart- en militaire technologie -industrie gegenereerd, omdat het een optie met een laag gewicht kan vertegenwoordigen in motoren voor raketten en antibala's vesten.
Ten slotte is het onlangs toegepast als vuurvast materiaal in de fusie van metalen in de metallurgische industrie.
Referenties
- Pubchem (s.F.)). Berylliumoxide. Verkregen van PubChem.NCBI.NLM.NIH.Gov
- Reade (s.F.)). Beryllia/berylliumoxide (bijeo). Reade van Reade.com
- Onderzoek, c. (S.F.)). Berylliumoxide - beryllia. Verkregen van Azom.com
- Diensten, n. J. (S.F.)). Berylliumoxide. Hersteld van NJ.Gov
- Wikipedia (s.F.)). Berylliumoxide. Verkregen van in.Wikipedia.borg

