Transformaties van materie
- 4315
- 438
- Glen Armstrong
 De transformaties van materie zijn die transformaties die het lijdt zonder de compositie te veranderen. Water in zijn vloeistof, vaste (ijs) of frisdrank (stoom) vorm blijft bijvoorbeeld water
De transformaties van materie zijn die transformaties die het lijdt zonder de compositie te veranderen. Water in zijn vloeistof, vaste (ijs) of frisdrank (stoom) vorm blijft bijvoorbeeld water Wat zijn de transformaties van materie?
De transformaties van materie zijn de veranderingen die dit lijdt zonder dat de samenstelling verandert. Dat wil zeggen, materie wordt getransformeerd wanneer het door fysische en chemische veranderingen doorloopt.
Voorbeelden van fysieke veranderingen zijn de vorming van ijs wanneer de temperatuur daalt, de dauw op de bladeren die in de ochtenden verschijnt, de dilatatie van de objecten wanneer verwarmd en de magnetisatie van een lichaam.
Van zijn kant is de oxidatie van schroeven en nagels een chemische verandering, omdat oxide een stof is die verschilt van het oorspronkelijke ijzer. In elk geval zijn veranderingen in energie noodzakelijk zodat deze transformaties plaatsvinden.
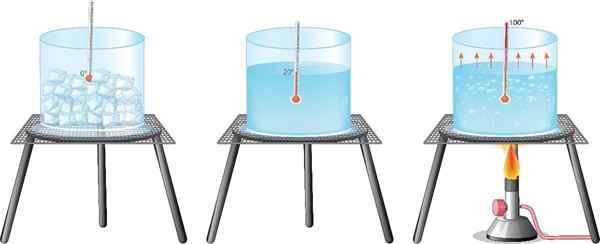
IJstransformatie is een toestandsverandering waarin water stolt, maar er zijn meer mogelijkheden. Materie komt in de natuur en in het laboratorium in verschillende staten, waarvan gas, vloeistof en vaste stof de drie meest voorkomende zijn, althans onder aardse omstandigheden.
Maar omdat materie verandert, zijn wetenschappers op experimentele en theoretische basis meer staten, van enigszins exotisch karakter, tegengekomen.
Het kan worden bevestigd dat er vijf fundamentele staten van materie zijn:
- Stevig
- Vloeistof
- Gas
- Plasma
- Bose-Einstein condensaat
Hiervan zijn de eerste drie stabiel in de omstandigheden van onze planeet, terwijl de laatste twee technologische middelen vereisen, hoewel ze in het universum frequent zijn. Plasma is in feite de meest voorkomende toestand van materie in de kosmos.
De fundamentele staten van materie
Onder de druk- en temperatuuromstandigheden van de aarde wordt materie normaal gesproken gepresenteerd in drie staten: vaste, vloeistof en gas, terwijl het plasma- en condensaatstaten van Bose-Einstein worden verkregen in verschillende omstandigheden, die in het laboratorium kunnen worden bereikt.
Kan u van dienst zijn: onconventionele maatregelenOm uit te leggen waarom, is het noodzakelijk om te onthouden dat materie bestaat uit deeltjes, gekoppeld door krachten, zowel aantrekkelijk als weerzinwekkend. Aantractiekrachten, zoals de naam al aangeeft, hebben de neiging om de deeltjes samen te stellen, terwijl de afstotende mensen het tegenovergestelde effect hebben.
Vaste stoffen, vloeistoffen en gassen
Wanneer de krachten van aantrekkingskracht overheersen tussen de deeltjes, blijven ze dicht bij elkaar, samen in min of meer vaste posities, wat aanleiding geeft tot de vaste stoffen. De deeltjes kunnen trillen, maar hun positie niet verlaten binnen de vaste stof, daarom handhaaft dit een gedefinieerde vorm en volume.
In de Vloeistoffen, Attractiekrachten laten deeltjes in de buurt doorgaan, maar zijn minder intens dan in vaste stoffen door ze de mogelijkheid te bieden om elkaar op een bepaalde manier te "glijden". Om deze reden passen vloeistoffen hun vorm aan aan de container die hen bevat, maar behouden hun vaste volume.
Eindelijk in de Gassen, Aantrekkelijke krachten zijn nog zwakkere, overwegend afstotingskrachten. Hierdoor blijven de deeltjes ver weg van elkaar, en met veel meer bewegingsvrijheid. Om deze reden breiden de gassen uit totdat het beschikbare volume volledig bezet.
Bose-Einstein condensaat en condensaat
Door voldoende verwarming gas, ionen en elektronen te scheiden in een proces dat wordt genoemd ionisatie, Op deze manier a plasma bij het laboratorium. De plasmastaat is niet gemakkelijk om op natuurlijke wijze in de buurt van de aarde te zien, maar het is te zien in de noordelijke en zuidelijke lichten.
Dit prachtige natuurlijke fenomeen treedt op wanneer de deeltjes van de zonnewind, een nogal diffuus plasma, de atmosfeer van de aarde beïnvloeden, ioniseren.
Aan de andere kant van de schaal, veel afkoelen, net boven de absolute nul, verschijnt een nieuwe staat van materie waarin de meeste deeltjes zich in de fundamentele staat bevinden, wat de laagste energie is.
Het kan je van dienst zijn: het belangrijkste aspect van kleine wetenschap, grote wetenschap en technowetenschapDeze staat van materie wordt genoemd Bose-Einstein condensaat, door natuurkundigen Satyendra Bose en Albert Einstein, die hun bestaan voorspelden in 1924.
Vele jaren later, in 1995, slaagden verschillende wetenschappers erin zeer verdunde gassen naar deze staat te dragen, een gemakkelijke taak, gezien het feit dat temperaturen van alleen nano-kelvin boven de absolute nul zijn vereist.
Staatsveranderingen in de zaak
In de natuur is het heel gebruikelijk dat de zaak van de ene staat naar de andere overgaat. Normaal gesproken zijn deze fysieke veranderingen te wijten aan variaties in druk en temperatuur, afgeleid van de toename of afname van deeltjesergie.
Wanneer thermische energie aan een materiaal wordt toegevoegd, neemt de kinetische energie van zijn deeltjes toe, waardoor de aantrekkingskracht wordt verminderd die ze in cohesie houdt. Als het materiaal in vaste toestand was, kan het dan naar de vloeibare toestand gaan of zelfs rechtstreeks naar de gasvormige toestand gaan.
Integendeel, het verwijderen van voldoende thermische energie, is het mogelijk om een gasvormig materiaal te laten transformeren naar vloeistof, of dat het van vloeistof naar vast. In elk geval verandert de samenstelling van de stof niet.
Het meest bekende voorbeeld voor iedereen is water: het is bekend dat een deel van vloeibaar water wordt omgezet in stoom wanneer het wordt gekookt, terwijl het overgaat om het in een vriezer te koelen.
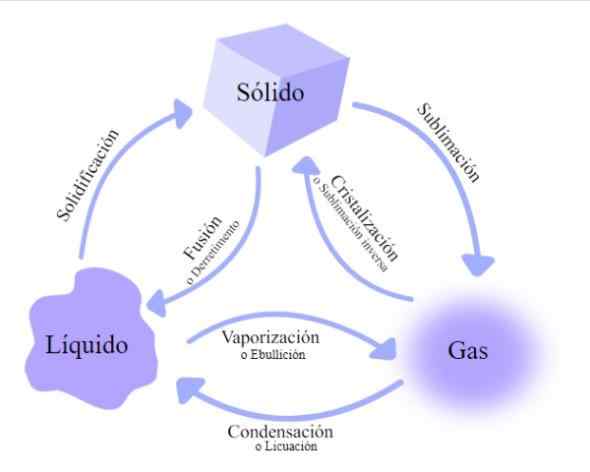 Veranderingen in de staat van materie. Bron: Wikimedia Commons
Veranderingen in de staat van materie. Bron: Wikimedia Commons Er zijn verschillende wisselkoersen waarmee materie passeert, geclassificeerd volgens de vraag of thermische energie toeneemt of afneemt:
- Progressief, Ze vinden plaats wanneer het materiaal thermische energie absorbeert.
- Regressief, Zij zijn degenen die zich voordoen wanneer het materiaal energie oplevert.
Progressieve transformaties
Onder de verschillende progressieve transformaties die in de kwestie plaatsvinden door energie toe te voegen, zijn:
Fusie
Verander die optreedt wanneer het materiaal van zijn vaste fase naar zijn vloeibare fase overgaat. Bijvoorbeeld door een ijsblok of verwarming of was te smelten.
Verdamping
In dit geval wordt de zaak door de vloeibare toestand getransformeerd naar de gasvormige toestand.
Kan u van dienst zijn: methodologieVerdamping vindt op twee manieren plaats:
- Kook-, vindt plaats wanneer het materiaal zijn bereikt kooktemperatuur, Op deze manier is energie voldoende om intermoleculaire krachten te overwinnen die deeltjes in hun vloeibare toestand houden. Elke stof heeft een karakteristieke kooktemperatuur, bij een bepaalde druk.
- Verdamping, Alleen oppervlakkige deeltjes veranderen toestand, omdat het materiaal niet op de temperatuur is die nodig is om in de kook te gaan. Het bekendste voorbeeld is de verdamping van water dat in een container achterblijft, bij kamertemperatuur.
Vervluchtiging
Ook gebeld sublimatie, Het vindt plaats wanneer het materiaal rechtstreeks vanuit de gasklasse omzet, zonder door de vloeibare fase te gaan.
Droog ijs is bijvoorbeeld koolstofdioxide2 vervluchtigd bij kamertemperatuur. Naftaleen, dat wordt gebruikt om insectenkleding te beschermen, gaat langzaam van solide naar een gas.
Ionisatie
Het is de doorgang van een plasmasas.
Regressieve transformaties
Zijn de transformaties veroorzaakt door de afname van de thermische energie van de deeltjes. Onder hen zijn:
Stolling
Het is de verandering van materie van de vloeibare toestand naar de vaste stof door te koelen, zoals het gebeurt bij het plaatsen van water in de vriezer. Het proces is omdat de stof energie oplevert aan de koude omgeving en ijs vormt.
Condensatie
Het treedt op bij het passeren van de gasvormige toestand naar de vloeibare fase, zoals bij de waterdamp in de lucht, bij het maken van contact met het koude oppervlak van de autoruiten.
Vloeibaarheid
Het is de transformatie van materie bij het passeren van gas naar vloeistof, zoals het gebeurt, koel ammoniak of koolstofdioxide met hoge druk.
Omgekeerde sublimatie
Dit is de doorgang van materie in een gasvormige tot vaste toestand, zoals bij het gasvormige jodium dat tegen een koud oppervlak botst, wat resulteert in de vorming van vaste kristallen. Het staat ook bekend als kristallisatie.
Desionering
Verandering van de plasmastatus in de gasvormige staat.
Referenties
- Chang, R. (2013). Scheikunde. 11VA. Editie. McGraw Hill Education.
- Giancoli, D. (2006 =. Fysica: principes met toepassingen. 6e. Ed Prentice Hall.
- Materie en zijn eigenschappen. Hersteld van: Elbibliote.com.
- Openentax. Scheikunde. Opgehaald uit: OpenStax.borg.
- Shipman, J. (2009). Een inleiding tot fysieke wetenschap. Twaalfde editie. Brooks/Cole, Cengage Editions.

