Natriumthiosulfaat (NA2S2O3)

- 1223
- 59
- Alton D'Amore
 Natriumthiosulfaatzouten. Met licentie
Natriumthiosulfaatzouten. Met licentie Wat is natrium thiosulfaat?
Hij natriumthiosulfaat of natriumhyposulfiet (NA2S2OF3) Het is een belangrijk anorganisch zout met verschillende medische toepassingen. Het is ook beschikbaar als je pentahydraatzout (na2S2OF3.5h2OF).
Het is een ionische verbinding gevormd door twee natriumkationen (NA+) en het negatief geladen thiosulfaatanion (s2OF3-), waarin het centrale zwavelatoom is gekoppeld aan drie zuurstofatomen en een ander zwavelatoom (vandaar de voorvoegsel -Tio), door eenvoudige en dubbele bindingen met resonantiekarakter. De vaste stof bestaat in een monokliene kristallijne structuur.
Natriumthiosulfaat kan verwarmingszwavel bereiden met een waterige natriumsulfietoplossing of een waterige natriumhydroxide -oplossing.
6naOH + 4S → NA2S2OF3 + 2e2S + 3H2OF
Dit is een medicijn dat op de lijst staat van essentiële geneesmiddelen van de Wereldgezondheidsorganisatie, de meest effectieve en veilige medicijnen die nodig zijn in een gezondheidssysteem.
Fysische en chemische eigenschappen
- Natriumthiosulfaat heeft een molecuulgewicht van 158,11 g/mol voor watervrije vorm en 248,18 g/mol voor de pentahydraatvorm.
- Presenteert een dichtheid van 1.667 g/ml.
- Natriumthiosulfaat is een kleurloos monoklinisch kristal zonder karakteristiek aroma. Deze vaste stof is efflorescerend, wat betekent dat deze op zichzelf tot stof kan worden gereduceerd door verlies van kristallisatiewater wanneer blootgesteld aan lucht.
- De verbinding heeft een smeltpunt van 48 ° C voor de pentahydraatvorm, en vanaf 100 ° C begint het te ontleden.
- Dan een2S2OF3 Het is zeer oplosbaar in water, in staat om 70 gram op te lossen per 100 milliliter oplosmiddel. De verbinding is praktisch onoplosbaar in ethanol.
Kan u van dienst zijn: absorptiespectrum- Natriumthiosulfaat is een neutraal zout dat gemakkelijk in water dissocieert om natrium- en thiosulfaat -ionen te geven. NA2S2OF3 Het is een stabiele vaste stof in normale omstandigheden, maar het ontleedt wanneer verwarmd om natriumsulfaat en natriumpolysulfide te geven:
4NA2S2OF3 → 3NA2SW4 + NA2S5
- Het breekt ook af wanneer het wordt behandeld met verdunde zuren om zwavel- en zwaveldioxide te geven (klokreactie genoemd):
NA2S2OF3 + 2HCl → 2NACL + S + SO SO2 + H₂o
- Stoichiometrisch reageert (in equimolaire hoeveelheden) met waterige jodiumoplossingen, dus het wordt veel gebruikt in laboratoria voor jodium -gebaseerde graden.
Reactiviteit en gevaren
Natriumthiosulfaat is geen giftig materiaal en wordt gebruikt voor medische doeleinden. Wanneer het echter ontleedt, produceert het giftige zwaveloxidedampen, die irritatie kunnen veroorzaken in de ogen, huid en slijmvliezen.
De verbinding kan de ogen, huid en luchtwegen irriteren. De stof is giftig voor de longen en slijmvliezen. Herhaalde of langdurige blootstelling aan de stof kan schade aan deze organen veroorzaken.
Als de verbinding in contact komt met de ogen, moeten de contactlenzen worden gecontroleerd en verwijderd, in het geval van het dragen ervan. De ogen met veel water moeten onmiddellijk gedurende minstens 15 minuten worden gewassen met koud water.
In het geval van huidcontact moet het getroffen gebied gedurende ten minste 15 minuten onmiddellijk worden gespoeld, terwijl de vervuilde kleding en schoenen worden verwijderd.
Je moet de huid bedekken die geïrriteerd is met een verzachtende. Was kleding en schoenen voordat je ze weer gebruikt. Als het contact ernstig is, was u met een desinfecterende zeep en bedekt u de huid besmet met een antibacteriële crème.
Kan u van dienst zijn: zuurstof: eigenschappen, structuur, risico's, gebruikIn geval van inhalatie moet het slachtoffer worden overgebracht naar een nieuwe plaats. Als u niet inademt, wordt kunstmatige ademhaling toegediend. Als ademhaling moeilijk is, moet er zuurstof worden verstrekt.
Als de verbinding wordt ingenomen, mag braken niet worden geïnduceerd, tenzij het medische personeel dit aangeven. Draai strakke kleding los, zoals shirthals, riem of stropdas.
In alle gevallen moet onmiddellijke medische zorg worden verkregen.
Toepassingen
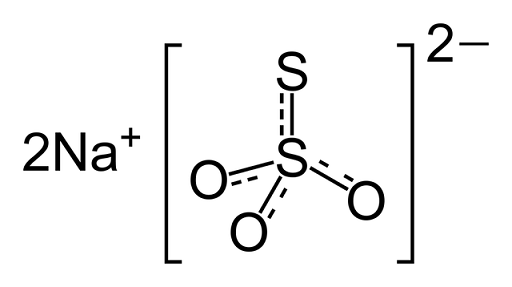 Chemische structuur van natriumthiosulfaat
Chemische structuur van natriumthiosulfaat Geneesmiddel
- Natriumthiosulfaat kan worden gebruikt om een deel van de bijwerkingen van de cisplatine te verminderen (een medicijn voor kanker).
- Het wordt gebruikt bij het beheer van extravasatie tijdens chemotherapie. Natriumthiosulfaat voorkomt alkylering en vernietiging van het weefsel, en biedt een substraat voor gehuurde agenten die onderhuidse weefsels zijn binnengevallen.
- Het wordt ook gebruikt met een ander medicijn bij de noodbehandeling van cyanidevergiftiging.
In deze behandeling wordt natriumnitriet intraveneus geïnjecteerd om hemoglobine te produceren die wordt gecombineerd met het cyanide -ion, waardoor het tijdelijk in de Cianemetoglobin -vorm wordt veranderd. Vervolgens wordt natriumthiosulfaat geïnjecteerd.
- Het dient als een substraat voor het Rodanasa -enzym, dat cyanide -conversie katalyseert in het veel minder giftige toxische toxiciaanse, dat in de urine wordt uitgescheiden.
- Het wordt ook gebruikt als een behandeling van calcifilaxis bij mensen in hemodialyse met terminale nierziekte. Blijkbaar is er een niet volledig begrepen fenomeen, waarbij dit bij sommige patiënten ernstige metabole acidose veroorzaakt.
Jodometrie
- Natriumthiosulfaat reageert stoichiometrisch met jodium om jodide te geven volgens de reactie:
Kan u van dienst zijn: ketonen: typen, eigenschappen, nomenclatuur, gebruik, voorbeelden2e2S2OF3 + I2 → S4OF62− + 2i-
Deze eigenschap maakt de verbinding die wordt gebruikt als titel bij de bepaling van jodium.
- Dit specifieke gebruik kan worden vastgesteld om het zuurstofgehalte van het water te meten door een lange reeks reacties in de Winkler -test voor opgeloste zuurstof.
- Het wordt ook gebruikt bij de volumetrische schatting van de concentraties van bepaalde verbindingen in oplossing (bijvoorbeeld waterstofperoxide) en bij de schatting van het chloorgehalte in het commerciële bleekpoeder en water.
Wateren van water
- Natriumthiosulfaat wordt gebruikt om water bekend te maken, inclusief de verlaging van de chloorniveaus voor gebruik in aquaria en zwembaden en spa's, en in de waterzuiveringsinstallaties om het achterste waswater te behandelen dat is vastgesteld vóór de afgifte in de rivieren.
De reductiereactie is analoog aan de jodiumreductiereactie, het thiosulfaat vermindert het hypochloriet (actief ingrediënt in het bleekmiddel) en het oxideert daarbij tot sulfaat. De volledige reactie is:
4NACLO + NA2S2OF3 + 2naOH → 4NACl + 2NA2SW4 + H2OF
Goudwinning
Natriumthiosulfaat is een component dat wordt gebruikt als een alternatief uitlogingsmiddel voor cyanide voor goudwinning. Het vormt echter een sterk oplosbaar complex met goudionen (i), [au (s2OF3))2]3-.
Het voordeel van deze benadering is dat thiosulfaat niet in wezen giftig is en dat de soorten mineraal die vuurvast zijn voor goudcyanratie kan worden uitgeloogd door thiosulfaat.
Referenties
- HSDB: Natriumthiosulfaat. Hersteld van toxnet.NLM.NIH.Gov.
- Veiligheidsgegevens Sheet natrium thiosulfaat watervrij materiaal. Hersteld van Sciencelab.com.

