Thermochemie

- 3944
- 1219
- Kurt Aufderhar Jr.
We leggen uit dat het thermochemie is, welke studies, zijn wetten en toepassingen
 In de thermochemie worden warmtemodificaties bestudeerd in chemische reacties
In de thermochemie worden warmtemodificaties bestudeerd in chemische reacties Wat is thermochemie?
De Thermochemie Het is verantwoordelijk voor de studie van de warmtemodificaties die worden uitgevoerd in de reacties tussen twee of meer chemische soorten. Het wordt beschouwd als een essentieel onderdeel van de thermodynamica, die de transformatie van warmte en andere soorten energie bestudeert om de richting te begrijpen waarin de processen worden ontwikkeld en hoe de energie varieert.
Het is ook essentieel om te begrijpen dat de warmte de overdracht van thermische energie die tussen twee lichamen plaatsvindt, omvat, wanneer deze zich bij verschillende temperaturen bevinden; Terwijl thermische energie wordt geassocieerd met de willekeurige beweging die atomen en moleculen bezitten.
Daarom, als bijna alle chemische reacties, wordt energie geabsorbeerd of vrijgegeven door warmte, de analyse van de fenomenen die optreden door thermochemie is zeer relevant.
Welke studies thermochemie?
De thermochemie bestudeert de warmteveranderingen in de vorm van warmte die optreden in chemische reacties of wanneer processen die impliceren van fysische transformaties optreden.
In die zin moeten bepaalde concepten binnen het onderwerp worden opgehelderd voor een beter begrip van hetzelfde.
Systeem
De term "systeem" verwijst bijvoorbeeld naar het specifieke segment van het universum dat wordt bestudeerd en wordt opgevat als "universum" de overweging van het systeem en zijn omgeving (alles extern voor dit).
Een systeem bestaat dus in het algemeen uit de soort die betrokken zijn bij de chemische of fysische transformaties die optreden in reacties. Deze systemen kunnen in drie typen worden ingedeeld: open, gesloten en geïsoleerd:
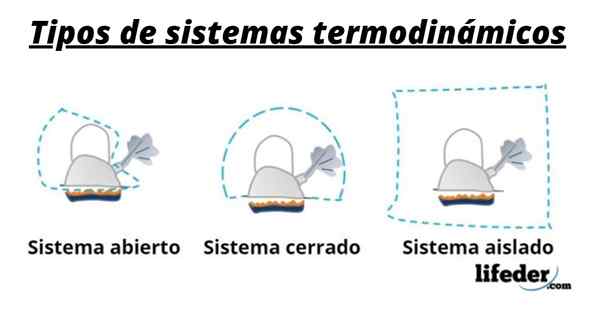
- Een open systeem is er een die de overdracht van materie en energie (warmte) met zijn omgeving mogelijk maakt.
- In een gesloten systeem is er energie -uitwisseling maar niet van materie.
- In een geïsoleerd systeem wordt de overdracht van materie of energie in de vorm van warmte niet gepresenteerd. Deze systemen staan ook bekend als "adiabatic".
Thermochemie -wetten
 Germain Hess, maker van de wet van Hess, fundamenteel voor thermochemie
Germain Hess, maker van de wet van Hess, fundamenteel voor thermochemie De wetten van de thermochemie zijn nauw verbonden met de wet van Laplace en Lavoisier, evenals de wet van Hess, die de voorlopers zijn van de eerste wet van de thermodynamica.
Het principe uiteengezet door de Franse Antoine Lavoisier (belangrijk chemisch en nobel) en Pierre-Simon Laplace (beroemde wiskundige, fysieke en astronoom) beoordeelt dat “de verandering in de energie die zich in een fysieke of chemische transformatie heeft, hetzelfde en betekenisvol heeft omvang in strijd met de verandering in de energie van de omgekeerde reactie ".
Hess Law
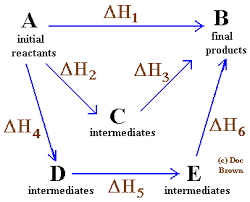
 Eenvoudig en algemeen diagram waar de HESS -wet voor vier chemische reacties wordt toegepast
Eenvoudig en algemeen diagram waar de HESS -wet voor vier chemische reacties wordt toegepast In dezelfde volgorde van ideeën is de wet geformuleerd door de Russische chemicus uit Zwitserland, Germain Hess, een hoeksteen voor de verklaring van thermochemie.
Dit principe is gebaseerd op de interpretatie van de wet op het gebied van energiebesparing, die verwijst naar het feit dat energie niet kan worden gecreëerd of vernietigd, alleen getransformeerd.
De wet van Hess kan op deze manier worden afgekondigd: "De totale enthalpie in een chemische reactie is hetzelfde, of de reactie in een enkele stap wordt uitgevoerd alsof het in een reeks van verschillende stappen gebeurt".
Totale enthalpie treedt op als de aftrekking tussen de som van de enthalpie van producten behalve de som van de enthalpie van de reactanten.
In het geval van verandering in standaard enthalpie van een systeem (in standaardomstandigheden van 25 ° C en 1 atm), kan het worden gechematiseerd volgens de volgende reactie:
Kan u van dienst zijn: chlorogeenzuurAHreactie = ΣδH(Producten) - ΣδH(Reactanten)
Een andere manier om dit principe uit te leggen, wetende dat de verandering van enthalpie verwijst naar de verandering van warmte in de reacties wanneer ze aan een constante druk worden gegeven, zegt dat de verandering in de net enthalpie van een systeem niet afhankelijk is van het pad dat volgt tussen de initiële toestand en het einde.
Eerste wet van de thermodynamica
Deze wet is zo intrinsiek gekoppeld aan de thermochemie dat het soms verward is welke de ene de andere inspireerde; Dus om lichten op deze wet te geven, moet men beginnen met te zeggen dat het ook zijn wortels heeft in het principe van energiebesparing.
Zodat thermodynamica niet alleen rekening houdt met warmte als een vorm van energieoverdracht (zoals thermochemie), maar ook andere vormen van energie omvat, zoals interne energie (OF)).
Dus de variatie in de interne energie van een systeem (Δu) wordt gegeven door het verschil tussen zijn initiële en uiteindelijke toestanden (zoals te zien in de Hess -wet).
Betrouw dat interne energie is samengesteld uit kinetische energie (deeltjesbeweging) en potentiële energie (interacties tussen deeltjes) van hetzelfde systeem, kan worden afgeleid dat er andere factoren zijn die bijdragen aan de studie van de toestand en eigenschappen van elk systeem.
Thermochemie -toepassingen
De thermochemie heeft meerdere toepassingen, sommige zullen hieronder worden vermeld:
- Bepaling van energieveranderingen in bepaalde reacties door het gebruik van calorimetrie (meting van warmteveranderingen in bepaalde geïsoleerde systemen).
- Aftrek van enthalpieveranderingen in een systeem, zelfs als ze niet bekend kunnen zijn bij een directe meting.
- Analyse van warmtetransfers geproduceerd experimenteel wanneer organometaalverbindingen met overgangsmetalen worden gevormd.
- Studie van energietransformaties (in warmte) gegeven in verbindingen van coördinatie van polyamines met metalen.
- Bepaling van de enthalpieën van de metaal-zuurstofverbinding van β-DIC's en β-DIC's verenigd tot metalen.
- Evenals in eerdere toepassingen kan thermochemie worden gebruikt om een groot aantal parameters te bepalen die zijn gekoppeld aan andere soorten energie- of toestandsfuncties, die de status van een systeem op een bepaald moment definiëren.
- Thermochemie wordt ook gebruikt in de studie van talloze samengestelde eigenschappen, zoals in titratiecalorimetrie.
Referenties
- Wikipedia. (S.F.)). Thermochemie. Opgehaald van.Wikipedia.borg
- Chang, R. (2007). Chemie, negende editie. Mexico: McGraw-Hill.
- Librhetxts. (S.F.)). Thermochemie - een recensie. Verkregen van chem.Librhetxts.borg
- Tyagi, p. (2006). Thermochemie. Hersteld uit boeken.Google.co.gaan
- Ribeiro, m. NAAR. (2012). Thermochemie en zijn toepassingen op chemische en biochemische systemen. Verkregen uit boeken.Google.co.gaan
- Singh, n. B., Das, s. S., En Singh,. K. (2009). Fysische chemie, deel 2. Hersteld uit boeken.Google.co.gaan

