Zeestheorie van elektronen fundamentals en eigenschappen
- 1608
- 338
- Cecil Graham
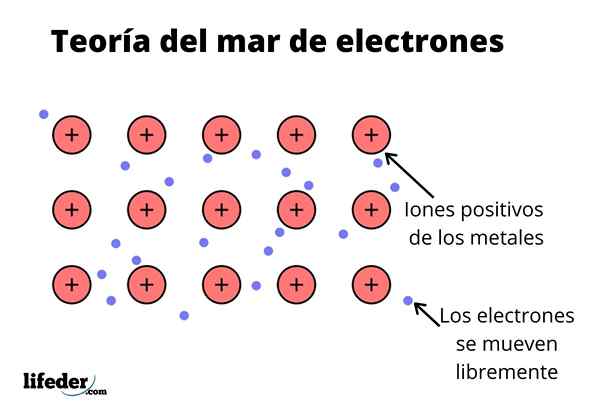
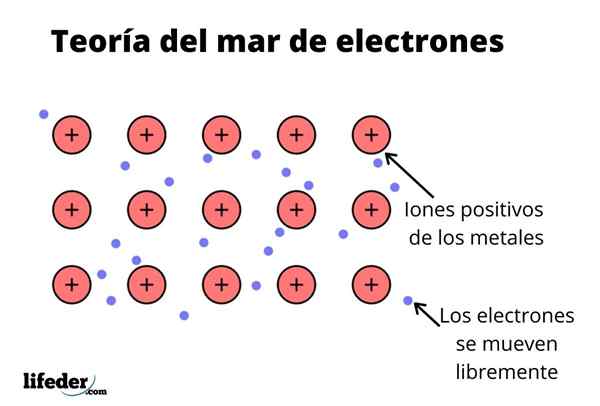
De Elektronenzee -theorie Het is een hypothese die een uitzonderlijk chemisch fenomeen verklaart dat optreedt in metaalbindingen tussen elementen met lage elektronegativiteiten. Dit is het delen van elektronen tussen verschillende verenigde atomen door metaalbindingen.
De elektronische dichtheid tussen deze bindingen is zodanig dat de elektronen worden verplaatst en een "zee" vormen waar ze vrij bewegen. Het kan ook worden uitgedrukt door de kwantummechanica: sommige elektronen (er zijn meestal één tot zeven per atoom) zijn gerangschikt in orbitalen met meerdere centra die door het metalen oppervlak worden uitgerekt.
Ook behouden elektronen een locatie in metaal, hoewel de waarschijnlijkheidsverdeling van de elektronische wolk een grotere dichtheid heeft rond sommige specifieke atomen. Dit komt omdat wanneer een specifieke stroom wordt toegepast, ze hun geleidbaarheid in een specifieke richting manifesteren.
[TOC]
Fundamentals of Electron Sea Theory
Metaalelementen hebben een grote neiging om elektronen van hun nieuwste energieniveau (valentielaag) te doneren, vanwege hun lage ionisatie -energie in relatie tot de andere elementen.
Dit wetende, kan elk metaalelement worden beschouwd als een kation dat is gekoppeld aan het elektron van zijn laatste energieniveau, dat meer vatbaar zou zijn om te doneren.
Net als in een metaal is er een groot aantal atomen die aan elkaar zijn gekoppeld, kan worden aangenomen dat dit metaal een groep metalen kationen vormt die worden ondergedompeld in een soort zee van valentie -elektronen met een grote verhuizing.
Gezien het feit dat de elektrostatische aantrekkingskrachten tussen het kation (positieve belasting) en het elektron (negatieve belasting) de atomen van het metaal sterk verbonden hebben, stel je dan de verplaatsing voor van de valentie -elektronen die zich gedragen als een elektrostatische lijm die gekoppeld is aan metaalkationen.
Kan u van dienst zijn: polymerenOp deze manier kan worden afgeleid dat hoe groter het aantal elektronen dat aanwezig is in de Valencia -laag van een metaal, dit soort elektrostatische lijm zal een grotere sterkte hebben.
Eigenschappen
De elektronenzee -theorie biedt een eenvoudige verklaring voor de kenmerken van metalen soorten zoals weerstand, geleidbaarheid, ductiliteit en kneedbaarheid, die variëren van het ene metaal tot het andere.
Er is ontdekt dat de weerstand die aan metalen wordt verleend, te wijten is aan de grote verplaatsing van hun elektronen, die een zeer hoge cohesiekracht genereert tussen de atomen die het vormen.
Op deze manier staat ductiliteit bekend als het vermogen van bepaalde materialen om de vervorming van hun structuur mogelijk te maken, zonder voldoende te geven om te breken, wanneer ze aan bepaalde krachten worden onderworpen.
Delocalisatie in de vorm van lagen
Zowel de ductiliteit als de kneedbaarheid van een metaal worden bepaald door het feit dat Valencia -elektronen in alle richtingen worden gedemoceerd in de vorm van lagen, waardoor ze elkaar verplaatsen vóór de werking van een externe kracht, waardoor de afbraak van de metaalstructuur wordt vermeden maar het mogelijk maakt zijn vervorming.
Evenzo zorgt de bewegingsvrijheid van verplaatst elektronen mogelijk een stroom van elektrische stroom, waardoor metalen een zeer goede elektriciteitsgeleidbaarheid hebben.
Bovendien maakt dit fenomeen van vrije verkeer van elektronen de overdracht van kinetische energie tussen de verschillende metaalgebieden mogelijk, die warmteoverdracht bevorderen en metalen een grote thermische geleidbaarheid manifesteert.
Het kan u van dienst zijn: jodosezuur (HiO2): eigenschappen en gebruikElektronenzee -theorie in metalen kristallen
Kristallen zijn vaste stoffen die fysische en chemische eigenschappen hebben - als dichtheid, smelten en hardheidspunt - die worden vastgesteld door het soort krachten dat de deeltjes die ze omvatten, bij elkaar worden gehouden.
In zekere zin wordt geacht dat metalen kristallen de eenvoudigste structuren hebben, omdat elk "punt" van het glasnetwerk is bezet door een atoom van het metaal zelf.
In dezelfde zin is vastgesteld dat de structuur van metalen kristallen over het algemeen kubiek is en zich richt op gezichten of lichaam.
Deze soorten kunnen echter ook een zeshoekige vorm hebben en hebben een vrij compacte verpakking, die hen die enorme dichtheid geeft die er kennelijk van is.
Vanwege deze structurele reden zijn de links die worden gevormd in metalen kristallen verschillen van die die voorkomen in andere klassen van kristallen. In de kristallijne structuur worden elektronen die bindingen kunnen vormen, zoals hierboven uitgelegd, eerder uitgelegd.

Nadelen van de theorie
In metaalatomen is er een kleine hoeveelheid valentie -elektronen in verhouding tot hun energieniveaus; Dat wil zeggen, er zijn een grotere hoeveelheid energietoestanden beschikbaar dan de hoeveelheid gekoppelde elektronen.
Dit houdt in dat, omdat er een sterke elektronische verhuizing is en ook energiebanden die gedeeltelijk zijn gevuld, elektronen door de reticulaire structuur kunnen bewegen wanneer ze worden onderworpen aan een elektrisch veld uit het buitenland, naast het vormen van de elektronen oceaan die de permeabiliteit van het netwerk.
Kan u van dienst zijn: oxácidoDus de vereniging van metalen wordt geïnterpreteerd als een conglomeraat van positieve ionen gekoppeld door een zee van elektronen (negatieve belasting).
Er zijn echter kenmerken die niet door dit model worden verklaard, zoals de vorming van bepaalde legeringen tussen metalen met specifieke composities of de stabiliteit van collectieve metaalverbindingen, onder andere.
Deze ongemakken worden verklaard door de kwantummechanica, omdat zowel deze theorie als vele andere benaderingen zijn vastgesteld op basis van het eenvoudigste model van een enkel elektron, terwijl ze proberen toe te passen in veel complexere structuren van multielektronische atomen.
Referenties
- Wikipedia. (2018). Wikipedia. Opgehaald van.Wikipedia.borg
- Holman, J. S., En steen, p. (2001). Scheikunde. Hersteld uit boeken.Google.co.gaan
- Parkin, g. (2010). Metaal-metaalbinding. Hersteld uit boeken.Google.co.gaan
- Rohrer, g. S. (2001). Structuur en binding in kristallijne materialen. Hersteld uit boeken.Google.co.gaan
- Ibach, h., en Lüth, h. (2009). Solid-state fysica: een inleiding tot principes van materiaalwetenschap. Hersteld uit boeken.Google.co.gaan
- « Cultureel hybridisatieproces, typen en voorbeelden
- 20 toeristische plaatsen van Aguascalientes (foto's) »

