Pure substanties

- 3420
- 842
- Alton D'Amore
We definiëren wat pure stoffen zijn, hun fysische en chemische eigenschappen, welke typen er zijn en we geven u talloze voorbeelden.
Wat zijn pure stoffen?
De pure substanties zijn allemaal die een constante en eigen chemische samenstelling presenteren. Dat wil zeggen, ze zijn homogeen, Dus ze worden alleen gevormd door atomen of moleculen die in hun respectieve symbolen of chemische formules voorkomen.
Pure stoffen kunnen worden geclassificeerd als eenvoudige (elementen) of verbindingen. Ze zijn eenvoudig als ze alleen bevatten Een enkel type atoom. Zijn verbindingen Als ze bezitten Twee of meer verschillende atomen het vormen van heterogene moleculen.
Voorbeelden van eenvoudige pure stoffen zijn goud (AU), koper (Cu) of zink (Zn). Als we andere verschillende atomen of elementen vinden, zullen ze niet langer zuiver zijn: goud gemengd met koper of koper gemengd met zink. Daarom, mengsels zijn geen pure stoffen.
Een voorbeeld van samengestelde zuivere stof is koolstofdioxide (CO₂), samengesteld uit twee zuurstofatomen en één koolstof. We kunnen identificeren dat het een pure stof is omdat U kunt uw formule schrijven.
Water (H₂o) is een ander voorbeeld van pure stof van samengestelde. Het zal echter ophouden puur te zijn als we suiker toevoegen: een mengsel van suiker en water is een mengsel, geen pure stof. Hetzelfde zou van toepassing zijn als we zouten erin oplossen.
Propieën van de pure stoffen
Pure stoffen hebben een reeks fysische en chemische eigenschappen:
Homogeniteit
Ze zijn homogeen, dus je kunt zeggen dat ze een hebben Constante compositieE in al zijn massa of uitbreiding.
Stel dat we een pure stof zoals ijzer (geloof) hebben. Als we het in kleinere ijzeren stukken verdelen, blijft het dezelfde fysische en chemische eigenschappen hebben.
Kan u van dienst zijn: propyleen (C3H6)Constante grootten van zijn eigenschappen
Een enkel type van atomen of moleculen In pure stoffen zijn hun fysische of chemische eigenschappen zeer goed gedefinieerd en presenteren ze geen grote variaties. Dat wil zeggen, hun eigenschappen hebben constante magnitudes of waarden bij dezelfde temperatuur of druk.
Bijvoorbeeld: puur water (h₂o) zal altijd kristallijn zijn en kookt op dezelfde temperatuur. Wanneer het echter wordt gemengd met andere stoffen, kan het bewolkt worden of van kleur veranderen. Dan beginnen de eigenschappen anders te zijn: verander de dichtheid, viscositeit, geur, de temperatuur waarbij het bevriest of kookt, enz.
Verschillende fysieke toestanden
Pure stoffen kunnen verschillende toestanden of fysieke fasen presenteren, het handhaven van de samenstelling en zuiverheid.
Gedestilleerd water is een zuivere stof die alleen wordt gevormd door H₂o -moleculen. Bij het bevriezen is het veranderd in ijs, maar de compositie ervan verandert niet. Hetzelfde gebeurt wanneer het verdampt: H₂o -moleculen blijven hetzelfde.
Water behoudt zijn zuiverheid in de drie fysieke toestanden, tenzij gemengd met andere elementen of verbindingen.
Beschrijving door chemische formule
Pure stoffen kunnen perfect worden beschreven Een chemische formule.
De H₂O -formule beschrijft bijvoorbeeld het water en zijn molecuul, zodat een zuivere watertank kan worden omschreven als H₂o niets meer.
Als we zout (NaCl) toevoegen aan deze zuivere watertank, hebben we een mengsel dat niet langer kan worden beschreven met de H₂o -formule en daarom is het geen pure substantie.
Wanneer een stof (vloeistof, vaste of frisdrank) niet gemakkelijk kan worden beschreven met een enkele chemische formule, dan is deze niet puur.
Soorten zuivere stoffen
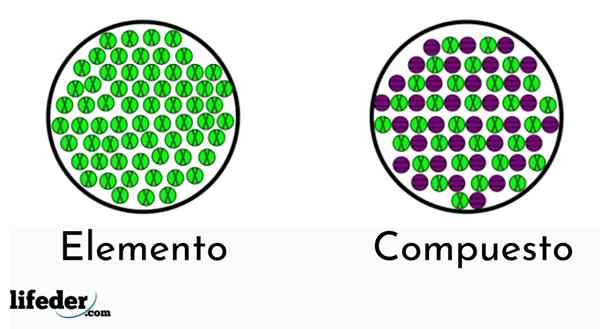 De elementen hebben slechts één type atoom, terwijl de verbindingen meer dan één type hebben
De elementen hebben slechts één type atoom, terwijl de verbindingen meer dan één type hebben Er zijn twee soorten zuivere stoffen: de eenvoudige (chemische elementen) en chemische verbindingen.
Kan u van dienst zijn: calciumcarbonaat: structuur, eigenschappen, formatie, gebruikEenvoudige stoffen (chemische elementen)
Een stof die alleen wordt gevormd door Een soort atoom overeenkomend met een chemisch element kan worden beschouwd als een zuivere stof. Dit is zodat er geen vervuiling is van de aanwezigheid van atomen van een ander chemisch element, of atomen van verschillende chemische elementen.
Puur zilver (Ag) wordt alleen gevormd door zilvermetaal (Ag) atomen. Evenzo kunnen de stukken nikkel (Ni) of koper (Cu) metalen worden beschouwd als zuivere stoffen, op voorwaarde dat ze niet aanwezig zijn in hun stukken besmetting van andere chemische elementen.
Integendeel, de legeringen zijn geen pure stoffen, omdat ze het gevolg zijn van het mengsel van twee of meer metalen. Daarom zijn brons of messing bijvoorbeeld geen pure stoffen.
Chemische bestanddelen
Een pure stof is een chemische verbinding als deze wordt gevormd door Twee of meer chemische elementen, die heterogene moleculen vormen, of een set ionische netwerken (zouten, oxiden, sulfaten, enz.)).
Een voorbeeld van chemische verbinding is ammoniak (NH3), gevormd door drie waterstofatomen en een stikstofatoom (NH3)). Het zal een pure substantie zijn als al zijn moleculen van hetzelfde type zijn en de NH -formule hebben3. Als het echter wordt gemengd met gasvormige zuurstof of waterdamp, dan zal het ophouden een zuivere stof te zijn (het zal een gasvormig mengsel zijn).
Voorbeelden van pure stoffen
Eenvoudige pure stoffen
- Magnesium (mg)
- Calcium (CA)
- Natrium (NA)
- IJzer (geloof)
- Tin (sn)
- Gasvormige zuurstof (of2))
- Helio (hij)
- Mercurius (HG)
- Koper (Cu)
- Nikkel (Ni)
Samengestelde zuivere stoffen
- Koolstofdioxide (CO₂).
- Koolmonoxide (CO).
- Glucose (c6H12OF6.)).
- Citruszuur (c6H8OF7)).
- Natriumsulfaat (NA2SW4)).
- Natriumhydroxide (NaOH).
- Water (H₂o).
- Natriumcarbonaat (NA2CO3)).
- Zwavelzuur (h2SW4.)).
- Natriumchloride (NaCl).
Advies om een pure stof te identificeren
Als u een formule van een stof kunt schrijven of het is een puur element, is het een pure substantie.
Thema's van belangstelling
Homogene mengsels
Heterogene mengsels
Referenties
- Helmestine, Anne Marie, pH.D. Definitie van pure stof. Hersteld van: Thoughtco.com
- CK-12 Foundation et al. Pure stoffen en mengsels. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg


