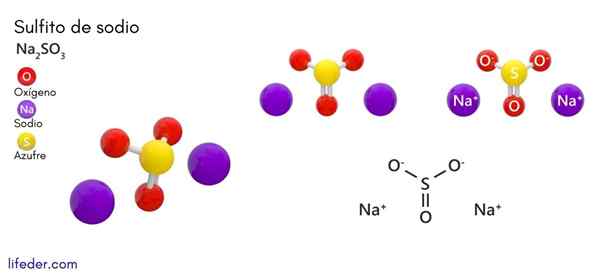
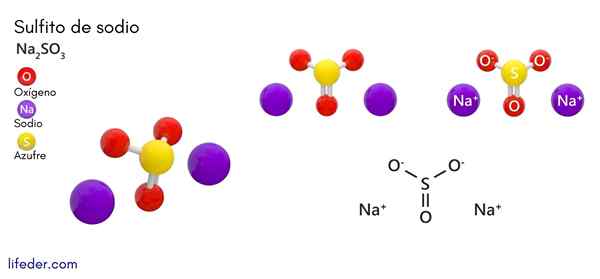
Natriumsulfiet (Na2SO3)
- 1089
- 270
- Kurt Aufderhar Jr.
Wat is natriumsulfiet?
Hij natriumsulfiet of natriumsulfiet, waarvan de chemische formule NA is2SW3, Het is een oplosbaar natriumzout dat wordt verkregen als een product van zwavelzuurreactie (of zwaveloxide (IV)) met natriumhydroxide.
Tussen 1650 en 1660 begon Glauber natriumsulfiet te produceren uit gemeenschappelijk zout (NaCl) en geconcentreerd zwavelzuur. Dit proces wordt beschouwd als het begin van de chemische industrie.
Het sulfietproces produceert houtpulp, dat wordt waargenomen als bijna zuivere cellulosevezel door verschillende zwavelzuurzouten te gebruiken om de lignine van houten splinters te extraheren.
Sulfieten hebben dus een groot aantal toepassingen van verschillende typen, waaronder in de voedingsindustrie als additief. Van de meest relevante functies, zijn enzymatische en niet -enzymatische bruin worden, controle en remming van microbiële groei, preventie van oxidatief wortel en de modificatie van de reologische eigenschappen van voedsel.
Natriumsulfietbereiding
In het algemeen komt natriumsulfiet op laboratoriumschaal op bij de reactie van natriumhydroxide -oplossing met zwaveldioxidegas (2NAOH + SO2 → Na2SW3 + H2OF).
Dan de evolutie van de SO2 Door een paar druppels geconcentreerd zoutzuur toe te voegen, geeft dit aan of natriumhydroxide bijna ontbreekt, veranderd in waterig natriumsulfiet (NA2SW3 + 2HCl → 2NACL + SO2 + H2OF).
Aan de andere kant wordt deze chemische verbinding industrieel verkregen door sulfidedioxide te reageren met een natriumcarbonaatoplossing.
Kan u van dienst zijn: Spectrale notatieDe eerste combinatie genereert natriumbisulfiet (nahso3), Dat door te reageren met natriumhydroxide of natriumcaroxide, het wordt omgezet in natriumsulfiet. Deze reacties kunnen in de globale reactie worden samengevat2 + NA2CO3 → Na2SW3 + CO2.
Chemische structuur
Alle vormen van natriumsulfiet worden gekenmerkt door witte, kristallijne en hygroscopische vaste stoffen, die de mogelijkheid hebben om gemakkelijk watermoleculen van de omringende omgeving aan te trekken en te behouden, die normaal gesproken bij kamertemperatuur zijn.
Het type kristallijne structuur is gekoppeld aan de aanwezigheid van water in de verbinding. Anhydrid natriumsulfiet presenteert een ortorrombische of hexagonale structuur en, in het geval er een aanwezigheid van watermoleculen in de verbinding is, verandert de structuur van zijn structuur (bijvoorbeeld heptahydraatnatriumsulfiet presenteert een monoklinische structuur).
Eigenschappen
Deze soort heeft bepaalde fysische en chemische eigenschappen die het onderscheiden van andere zouten, die hieronder worden beschreven:
Chemische eigenschappen
Als verzadigde waterige oplossing heeft deze stof een geschatte pH van 9. Bovendien oxideren de oplossingen die worden blootgesteld aan de lucht uiteindelijk natriumsulfaat.
Aan de andere kant, als het natriumsulfiet van de waterige oplossing mogen kristalliseren bij kamertemperatuur of lager, doet het het als een hepthydraat. Heptahydraten kristallen effloresce in hete en droge lucht, ze oxideren ook in de lucht om sulfaat te vormen.
In deze zin is de anhydra -vorm veel stabieler tegen luchtoxidatie. Sulfiet is onverenigbaar met zuren, sterke oxidatiemiddelen en hoge temperaturen. Het is ook onoplosbaar in ammoniak en chloor.
Kan u van dienst zijn: isopropylalcoholFysieke eigenschappen
Anhydrid natriumsulfiet heeft een molaire massa van 126,43 g/mol, een dichtheid van 2.633 g/cm3, Een fusiepunt van 33,4 ° C (92,1 ° F of 306,5 K), een kookpunt van 1.429 ° C (2,604 ° F of 1.702 K), en is niet ontvlambaar. Ook is oplosbaarheid (gemeten bij een temperatuur van 20 ° C) 13,9 g/100 ml.
Gebruik/toepassingen
Vanwege zijn reactieve eigenschappen is natriumsulfiet zeer veelzijdig en gebruikt momenteel breed soorten industrieën.
- Het wordt veel gebruikt bij waterbehandeling en eliminatie van opgeloste zuurstof in waterketels.
- Het heeft ook toepassingen in de papieren industrie (semi -kid pulp).
- In fotografie wordt het gebruikt bij de productie van onthullen.
- In een passende mate wordt het gebruikt in het behoud van voedsel en antioxidant.
- In de textielindustrie wordt het gebruikt bij het witwassen van en anticloorprocessen.
- Het wordt ook gebruikt als een reductiemiddel.
- Bovendien wordt het gebruikt bij het secundaire herstel van oliebronnen.
- Het wordt zelfs gebruikt bij de productie van organische verbindingen, kleurstoffen, inkten, viskeuze rayon en rubbers.
- Het wordt gebruikt bij de productie van talloze chemicaliën, waaronder kaliumsulfaat, natriumsulfiet, natriumsilicaat, natriumhyposulfiet en natriumaluminiumsulfaat.
Risico's
Effecten voor blootstelling aan verbinding
Langdurige of herhaalde blootstelling aan deze stof kan dermatitis en gevoeligheidsreacties veroorzaken. Blootstelling in sulfietgevoelig, astmatisch en atopisch.
Evenzo kan de zuurontleding van natriumsulfiet toxische en gevaarlijke rook van zwaveloxiden afgeven, waaronder zwaveldioxide, die permanente longverdediging kunnen veroorzaken als gevolg van chronische en acute blootstelling.
Kan u van dienst zijn: ididio 192Evenzo is acute vergiftiging door zwaveldioxide zeldzaam omdat gas gemakkelijk kan worden gedetecteerd. Het is zo irritant dat contact niet kan worden getolereerd.
Onder de symptomen, hoest, gerucht, niezen, scheuren en ademhalingsmoeilijkheden zijn inbegrepen. Werknemers met een hoge onvermijdelijke blootstelling kunnen echter belangrijke en mogelijk dodelijke longschade lijden.
Ecotoxiciteit
Natriumsulfiet is een niet -bescheidende oplossing, die vaak wordt gebruikt als een resterende waterdalingsmiddel. Hoge concentraties dragen bij aan de grote vraag naar chemische zuurstof in wateromgevingen.
Voedselconsumptie met conserveermiddelen
Een van de additieven die problemen bij gevoelige mensen kunnen veroorzaken, is de groep die bekend staat als sulfitatie-middelen, waaronder verschillende sulfiet anorganische additieven (E220-228), waaronder natriumsulfiet (dus dus2)).
Bij overgevoelige of astmatische mensen, de consumptie van voedingsmiddelen met sulfieten of het inademen van zwaveldioxide kan het giftig zijn.
Deze verbindingen zijn verantwoordelijk voor bronch-constructie die zich vertaalt in ademhalingsmoeilijkheden. De enige behandeling voor deze overmatige reactie is het vermijden van voedsel en drankjes die sulfieten bevatten.