Kenmerken, typen en functieselectins
- 1575
- 20
- Glen Armstrong
De Selectinas Ze zijn een familie van glycoproteïnen gevormd door polypeptideketens, die specifieke conformaties van suikers (koolhydraten) herkennen, gelegen op het oppervlak van andere cellen en eraan binden. Om deze reden worden ze ook adhesiemoleculen genoemd.
Deze hechtingsreceptoren staan bekend om hun bewaarde structuur. Ze presenteren drie domeinen en drie verschillende glycoproteïnen. Ze kunnen worden uitgedrukt als oppervlaktemoleculen, naast het worden opgeslagen of functioneren als oplosbare moleculen.
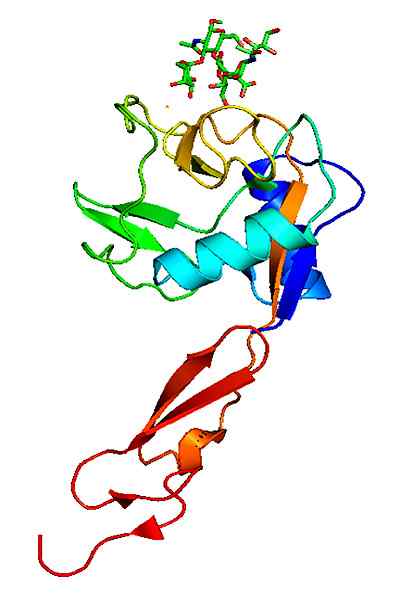
 Moleculaire structuur van een p-selectine. Genomen en bewerkt uit: Neveu, Curtis [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)].
Moleculaire structuur van een p-selectine. Genomen en bewerkt uit: Neveu, Curtis [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. In tegenstelling tot andere adhesiemoleculen werken de selectines alleen in de interacties van de witte bloedcellen met het vasculaire endotheel.
[TOC]
Kenmerken
De selectins zijn allemaal eiwitten die ketenoligosachariden bevatten, verenigd door covalente bindingen aan laterale aminozuurketens (glycoproteïnen). Het zijn transmembraanmoleculen, wat betekent dat ze de lipide bilay oversteken.
Ze delen kenmerken die erg vergelijkbaar zijn met CLEC- of lectinas type C -eiwitten. Omdat, als type C lectina's, selectines calciumionen vereisen om de kruising uit te voeren.
De oorsprong van het woord "selectin" verwijst naar het feit dat deze eiwitten selectief tot expressie brengen in vasculaire systeemcellen en ook een lectinedomein bevatten.
Sommige auteurs zijn selectines (glycoproteïnen) in de lectinas omdat het moleculen zijn die binden aan suikers. Andere auteurs onderscheiden ze echter onder het concept dat lectinas alleen koolhydraten herkennen en zich bij hen aansluiten, terwijl selectins niet alleen suikers herkennen en samenvoegen, maar ook worden gevormd door koolhydraten.
De regulatie van de selectins vindt plaats op transcriptieniveau, door proteolytische verwerking, door cellulaire classificatie en door gereguleerde expressies van glycosil-transferasen.
De selectins hebben een kort intracellulair domein. Ze hebben echter drie extracellulaire domeinen, een domein van het type epidermale groeifactor, een domein van de lectinetype C en herhalingseenheden, vergelijkbaar met de regulerende eiwitten van de complement.
Kan u van dienst zijn: Hele cellen: geschiedenis, kenmerken, celcyclus en gebruikJongens
De SelectIn -familie bestaat uit drie verschillende soorten glycoproteïnen. Elk van deze wordt geïdentificeerd met een letter die de plaats aangeeft waar ze voor het eerst zijn geïdentificeerd. Vervolgens zullen we ze allemaal zien.
L-selectine
Het is ook bekend als Sell, CD62L, Lam1, Leu8, LNHR, Lsel of TQ1. Het wordt gevonden in leukocyten, vandaar de "L" van de selectin. Het is een celoppervlakcomponent. De drie domeinen zijn: een tegenhanger van de lectina's, een epidermale groeifactor en twee consensus van herhalingseenheden.
Het presenteert verschillende liganden, dat wil zeggen in het algemeen kleine moleculen die complex vormen met een biomolecuul, in dit geval een eiwit. De bekende liganden voor L-selectine zijn de volgende.
Glycam1
Bekend als de molecuul -1 van cellulaire hechting die afhankelijk is van glycosylatie, is het een proteoglycan -ligand dat tot expressie wordt gebracht in post -chapillaire veneuze ontstekingen en lymfocyten in staat stellen naar de bloedbaan naar lymfoïde weefsels te gaan.
CD34
Het is een fosfo enchoproteïne, gedetecteerd in verschillende groepen zoogdieren, zoals man, ratten en muizen, onder anderen. Het werd voor het eerst beschreven in hematopoietische stamcellen. Ze worden gevonden in verschillende cellen, maar het is bijna uitsluitend gerelateerd aan hematopoietics.
Madcam-1
Bekend als ad -hars- of celadhesiemolecuul in de richting van het vasculaire slijmvlies (in het Engels, vasculair slijmvliesadresinemolecuul 1). Het is een extracellulair eiwit van het endotheel dat verantwoordelijk is voor het bepalen van in welk weefsel de lymfocyten binnenkomen, naast het dragen van suikers zodat ze worden herkend door de L-selectine.
PSGL-1
Onder andere synoniemen bekend als Selplg of CD162, is het een glycoproteïne dat wordt aangetroffen in endotheelcellen en in leukocyten. U kunt deelnemen aan de andere twee soorten selectins. Het lijkt er echter op dat het een betere affiniteit met p-selectine presenteert.
Kan u van dienst zijn: schimmelcellen: kenmerken, organellen en functiesP-selectine
P-selectine is bekend onder andere namen zoals SELP, CD62, CD62P, GMP140, GRMP of LECAM3, onder andere. Het bevindt zich op het oppervlak van de endotheelcellen, die de interne marges van bloedvaten en bloedplaatjes bedekken.
P-selectine werd voor het eerst geïdentificeerd in bloedplaatjes. Daarom draagt de naam van het eiwit de eerste "P".
De structuur van het P-selectine bestaat uit een domein dat erg lijkt op het type C-lectine aan het N EGF-uiteinde; dat wil zeggen een geconserveerd eiwitdomein van ongeveer 30 tot 40 aminozuurafval, met een tweekrachtig β-blad gevolg.
Het presenteert een derde doming vergelijkbaar met complementeiwit als complement call.
Het ligand met een grotere affiniteit van het P-selectine is PSGL-1, zoals eerder beschreven in de L-selectin-liganden. Aan de andere kant kan dit eiwit ook complexen vormen met andere moleculen zoals gesulfateerd polysaccharide genaamd fucoidan en heparán sulfaat.
E-selectine
Dit selectine -eiwit is ook bekend onder de volgende namen: SELE, CD62E, ELAM, ELAM1, ELES, LECAM2 en andere. Het wordt exclusief tot expressie gebracht in endotheelcellen die worden geactiveerd door kleine eiwitten die niet in staat zijn om de lipide dubbellaag van de cel te kruisen, cytokines genoemd.
De structuur van dit eiwit bestaat uit 3 domeinen (zoals de rest van de selectines): een domein vergelijkbaar met EGF, 6 eenheden van controle -eiwitmodules (ook wel sushi -domeinen genoemd) van herhaalde SCR en een transmembraandomein.
Het kan je van dienst zijn: megacariocyten: kenmerken, structuur, vorming, rijping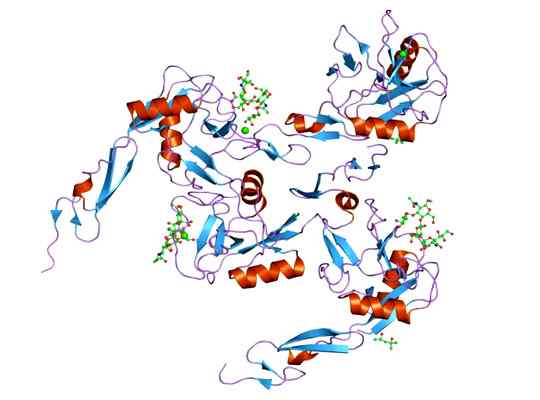 Weergave van de moleculaire structuur van het e-selectine-eiwit, waarvan de domino EGF is. Genomen en bewerkt uit: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain].
Weergave van de moleculaire structuur van het e-selectine-eiwit, waarvan de domino EGF is. Genomen en bewerkt uit: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain]. Het ligand dat complexen vormen met het e-selectieve is behoorlijk gevarieerd, maar degenen die opvallen zijn de volgende.
Sialyl-lewis a
Ook SLE A O CA19-9 genoemd. Het is een tetrasaccharide in sera van kankerpatiënten. Het is bekend dat het deelneemt aan het cel-celherkenningsproces. Het wordt constitutief uitgedrukt in granulocyten, monocyten en lymfocyten t.
Sialyl-Lewis x
Het is ook een tetratasaccharide zoals Siylyl-Lewis A en heeft vergelijkbare functies. Het wordt uitgedrukt in granulocyten en monocyten en regelt de ongewenste uitgang of lekkage van deze cellen tijdens ontsteking.
PSGL-1
Hoewel het blijkbaar efficiënter is in p-selectine, zijn sommige auteurs van mening dat de vorm afgeleid van menselijke neutrofielen ook vrij efficiënt is in e-selectine. Ze zijn zelfs van mening dat dit ligand in het algemeen fundamenteel is voor de drie soorten selectins.
Functie
De hoofdfunctie van de selectins is om deel uit te maken van het witte bloedcelvormingsproces (lymfocyten). Ze nemen ook deel aan de immuunrespons, in chronische en acute ontstekingen in verschillende organen van het lichaam, zoals nieren, hart en huid. Ze werken zelfs in de ontstekingsprocessen van carcinogene metastasen.
Referenties
- Selecteren. Opgehaald uit: in.Wikipedia.borg.
- L-selectine. Opgehaald uit: in.Wikipedia.borg.
- CA19-9. Opgehaald uit: in.Wikipedia.borg.
- E-selectine. Opgehaald uit: in.Wikipedia.borg.
- X. Zou, v.R. Shinde Patil, n.M. Dagia, l.NAAR. Smith, m.J. Wargo, K.NAAR. Interliggi, c.M. Lloyd, D.F. T -stukken, B. Walcheck, m.B. Lawrence, D.J. Goetz (2005). PSGL-1 die is ontleed uit menselijke neutrofielen is een zeer efficiënt ligand voor edothelium-express e-selectine onder stroming. American Journal of Physiology. Celfysiologie.
- K. Law (2001). Functies van selectins. Resultaten en problemen bij celdifferentiatie.
- Selectinas. Hersteld van: WellPath.Uniovi.is.
- J.H. Pérez & C.J. Montoya. Adhesiemoleculen. Opgehaald uit: Encolombia.com.
- NAAR.C. Sanguineti & J.M Rodríguez-Tafur (1999). Hechting en huidmoleculen. Peruaanse dermatologie.
- T.F. Tedder, D.NAAR. Steeber, een. Chen, p. Engel (1995). De selectins: vasculaire adhesiemoleculen. FASEB Journal.
- « Witte mangrove -functies, habitat, taxonomie, gebruik
- Integrins kenmerken, structuur en functies »

