Samario -kenmerken, structuur, verkrijgen, gebruik

- 4458
- 209
- Ernesto McKenzie
Hij samarium Het is een chemisch element dat behoort tot de zeldzame aardes, met name tot de lanthaniden, en wiens symbool SM is. Zijn naam komt van het Samarskita -mineraal, ter ere van kolonel Vassili Samarsky, die een Russische mijnbouwofficier was, en die monsters van dit mineraal schonk voor zijn studie. De Franse chemicus, Paul Émile Lecoq, verkreeg zijn oxide en enkele van zijn zouten uit de Samarskita in 1879, terwijl hij in Parijs werkte.
Lecoq van Boisbaudran krijgt meestal verdienste voor de ontdekking van het samarium, hoewel er andere chemicaliën en mineralogisch waren die eerder de manier trokken om het te vinden. Het was pas in 1901 dat de Franse chemicus Eugène Anatole erin slaagde het eerste pure samariummonster te produceren.
 Samario Samario bewaarde strak in een blaar. Bron: Hi-Res Images ofChemical Elements/CC door (https: // creativeCommons.Org/licenties/door/3.0)
Samario Samario bewaarde strak in een blaar. Bron: Hi-Res Images ofChemical Elements/CC door (https: // creativeCommons.Org/licenties/door/3.0) De reden voor deze vertraging in het isolement was te wijten aan het feit dat de Samario een relatief reactief metaal is, dus het is niet zuiver van aard, maar maakt deel uit van veel minerale massa's. Evenzo houdt het een nauwe geologische relatie bij met andere elementen van zeldzame aardes zoals het europium en het neodymium, dus het is moeilijk om het van dergelijke verontreinigende stoffen te scheiden.
Samario is een metaal met zeer diverse toepassingen, die worden gebruikt voor kanker, dating, kernreactoren, organische magneten en katalyse.
[TOC]
Samario -kenmerken
Fysiek
De Samario heeft een zilveren witte glans, maar dat wordt al snel goud2OF3, die Samaria wordt genoemd. Het is een van de moeilijkste en meest vluchtige lantanide -metalen, met respectievelijk 1072 en 1900 ºC fusie en kookpunten.
Het oxideert met relatieve traagheid wanneer het wordt blootgesteld aan lucht of ondergedompeld in minerale olie. Daarom moet het worden opgeslagen in blaren, of binnen containers verzegeld met argon of ander inert gas. Wanneer hij op 150 ºC wordt verwarmd, oxideert hij krachtig en zegt het brandende vonken als hij hard ligt.
Kan u van dienst zijn: lutecio: structuur, eigenschappen, gebruik, verkrijgenChemicaliën
De Samario vertoont, net als de andere lantaniden, een oxidatietoestand van +3 in bijna al zijn verbindingen; dat wil zeggen, het wordt gevonden als een smation3+. Het is echter ook in staat om de oxidatiestatus van +2, SM over te nemen2+, In verbindingen zijn zoals SMO (samariummonoxide), sms (samarium monosulfide) en SMI2 (Samario diyoduro).
Lost op in heet water en vooral in verdunde zuren, zoals HCl, h2SW4 en ch3COOH; Met uitzondering van HF, omdat het een SMF -beschermende laag vormt3 zijn ontbinding vertragen. Uw oxide, sm2OF3, Het is matig eenvoudig, dus wanneer het oplost in water, zal het opmerkelijke hoeveelheden OH -ionen vrijgeven- Door actie van SM Hydroxide (OH)3.
De meeste samariumverbindingen +3 worden gekenmerkt door geelgroene kleuren, en sommige vallen zelfs op omdat ze luminescent zijn.
Chemische structuur
Bij kamertemperatuur neemt het samarium een rhombohedrale kristallijne structuur aan, die overeenkomt met de polymorfe of α -fase. Wanneer het wordt verwarmd op 731 ºC, treedt er een fase -overgang op, waardoor zijn kristallen worden verdicht aan een compacte hexagonale structuur (HCP), fase β β genoemd.
Doorgaan met de verwarming bij een temperatuur van 922 ºC, lijdt de Samario een andere overgang naar een kubieke structuur gecentreerd in het lichaam (BCC), γ -fase genoemd.
Samario -kristallen kunnen ook andere overgangen ondergaan wanneer ze onder hoge druk worden gecomprimeerd, in de orde van duizenden kilobares, zijnde de tetragonale en dubbele compacte zeshoekige (DHCP) enkele van de structuren verkregen in deze studies.
Elektronische configuratie
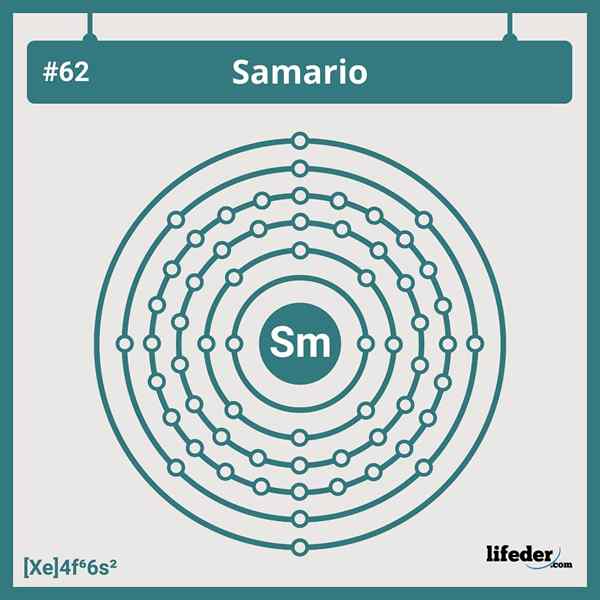 Samario elektronische configuratie
Samario elektronische configuratie De verkorte elektronische configuratie van de Samario is:
Kan u van dienst zijn: dihydroxyacetonfosfaat (DHAP): kenmerken en toepassingen[Xe] 6s24F6
Het heeft zes elektronen in zijn 4F -orbitalen, die overeenkomen met zijn positie in de zesde groep van de lanthaniden. Daarom gaat de elektronische configuratie niet over een van de vele afwijkingen die we in het periodiek systeem zien.
Het verkrijgen van
 Monazite Mineral Sand, hoofdgrondstoffen om het samarium te verkrijgen. Bron: D. Kemp, a. C. Cillierslicht gemodificeerd door Gretarsson (Red, Slecht zichtbare SCA-bar vervangen door een witte)/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)
Monazite Mineral Sand, hoofdgrondstoffen om het samarium te verkrijgen. Bron: D. Kemp, a. C. Cillierslicht gemodificeerd door Gretarsson (Red, Slecht zichtbare SCA-bar vervangen door een witte)/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0) Ondanks dat het deel uitmaakt van de zeldzame aardes, is de overvloed van de Samario superieur aan die van tin en andere metalen. Het wordt geassocieerd met roest van zeldzame aardmetalen, samen met deze mineralen zoals Cerita, La Gadolinita, La Monazita en La Bastnasita, de Monazite is een van de belangrijkste mineralogische bronnen, omdat het ongeveer 2 bevat.8% samarium.
Er zijn verschillende methoden om het te verkrijgen. Een van hen bestaat uit het verwerken van de monazietzanden en het scheiden van de smionen3+, hetzij door oplossingen en daaropvolgende extracties van oplosmiddelen, of het gebruik van ionenuitwisselingchromatografie.
Samario's ionen worden verkregen als SMCL3, Ze worden onderworpen aan elektrolyse met een gesmolten mengsel van NaCl of CaCl2. Aan de andere kant, als deze ionen worden verkregen als smeren2OF3, Dan wordt het oxide verminderd in een tantalium smelten met behulp van lantano, waarbij samariumdampen worden gedestilleerd vanwege hun lagere kookpunt. De vergelijking voor deze reductie is als volgt:
GIJ2OF3 + 2LA → 2SM + de2OF3
De reductie wordt heet uitgevoerd (bijna 1400 ° C) en binnen een vacuüminductie -oven, die de destillatie van de dampen als gevolg van samarium verder versnelt.
Gebruikt/toepassingen van de samario
Magneten
 SMCO -magneten worden gebruikt als onderdeel van de functionele componenten van kwartshorloges. Bron: © 2010 door Tomasz Sienicki [Gebruiker: TSCA, Mail: Tomasz.Sienicki op Gmail.com]/cc door (https: // creativeCommons.Org/licenties/door/3.0)
SMCO -magneten worden gebruikt als onderdeel van de functionele componenten van kwartshorloges. Bron: © 2010 door Tomasz Sienicki [Gebruiker: TSCA, Mail: Tomasz.Sienicki op Gmail.com]/cc door (https: // creativeCommons.Org/licenties/door/3.0) De Samario wordt gelegeerd met de kobalt om aanleiding te geven tot de SMCO -legeringen, waarvan de magnetisatie permanent is en ongeveer 10000 keer hoger is dan die van ijzer.
Kan u van dienst zijn: eenheidsbewerkingenDeze Samario-Colto-magneten worden voornamelijk gebruikt in de luiken van de camera's, hoofdtelefoons, motoren, elektrische gitaarpillen, evenals in militaire toepassingen waar ze temperaturen ondersteunen die groter zijn dan 400 ° C.
Geneesmiddel
 Moleculaire structuur quadramet, 153SM-EDTMP.
Moleculaire structuur quadramet, 153SM-EDTMP. De Samario zelf is relatief giftig. Een van de radioactieve isotopen, de 153SM, geklaagd door een EDTMP -molecuul (ethylendiaminotetramethyleen -fosfonaat, afbeelding hierboven), dient om pijn te bestrijden bij de behandeling van prostaatkanker, long en borsten. Dit medicijn wordt Samario (153SM) lexidronam genoemd, commercieel bekend als quadramet.
Kernreactor
De isotoop 149SM is een uitstekende neutronenabsorberende, dus het wordt gebruikt in kernreactoren om reacties te regelen en een explosie te voorkomen.
elektronica
De sms maakt het temperatuurverschil in elektriciteit, dus wordt het gebruikt als thermo -elektrisch in verschillende apparatuur. Het heeft ook de eigenaardigheid om metallic te worden onder relatief lage druk.
Dating
Het alfa -verval van de isotoop 147Ye (T1/2= 1.06 × 10elf) naar de isotoop 143Nd, wordt gebruikt om monsters van rotsen of meteorieten binnen of buiten de aarde te dateren. Heeft het voordeel dat atomen 147SM en 143En deelt dezelfde geologische kenmerken, dat wil zeggen dat ze geen grote scheidingen lijden tijdens metamorfe processen.
Katalyse
De Samario wordt gebruikt in organische synthese zoals SMI2, fungeren als een reductiemiddel in tal van synthese van synthetische versies van natuurlijke producten. Aan de andere kant, de sm2OF3 Het is een katalysator voor de uitdroging en dehydrogenering van ethanol.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (vierde druk). MC Graw Hill.
- Wikipedia. (2020). Samarium. Opgehaald uit: in.Wikipedia.borg
- Oleg D. Neikov, & Stanislav s. (2019). Handboek van non-ferrometaalpoeders: technologieën en toepassingen. (Tweede druk). Wetenschappelijk.
- De redacteuren van Enyclopaedia Britannica. (2020). Samarium. Hersteld van: Britannica.com
- Nationaal centrum voor biotechnologie -informatie. (2020). Samarium. Pubchem -element. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Dr. Doug Stewart. (2020). Samarium -elementenfeiten. Hersteld van: chemicool.com
- Strekopytov, s. (2016). Groet naar samarium. Nature Chem 8, 816. doen.org/10.1038/NHEM.2565

