Rubidio historia, eigenschappen, structuur, verkrijgen, gebruik

- 2162
- 109
- Nathan Wiegand
Hij rubidium Het is een metalen element dat behoort tot groep 1 van de periodieke tabel: dat van alkalische metalen, die worden weergegeven door het RB -chemisch symbool. Zijn naam klinkt als Rubí, en dat is omdat toen zijn emissiespectrum werd ontdekt, hij intense rode karakteristieke lijnen liet zien.
Het is een van de meest reactieve metalen die bestaan. Het is de eerste van de alkalische metalen die, ondanks dat het weinig dicht is, in het water zinkt. Het reageert ook met haar meer explosiever vergeleken met lithium, natrium en kalium. Er zijn experimenten geweest waarin de ampullen worden opgeslagen (lagere afbeelding) om te vallen en te exploderen in badkuipen.
 Ampoule met een gram rubidium opgeslagen onder een inerte atmosfeer. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]
Ampoule met een gram rubidium opgeslagen onder een inerte atmosfeer. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] Rubidio onderscheidt zich door een metaal duurder te zijn dan hetzelfde goud; Niet zozeer vanwege zijn tekort, maar vanwege zijn brede mineralogische verdeling in de aardkorst en de moeilijkheden die zich voordoen bij het isoleren van kalium en staken verbindingen.
Het toont een duidelijke neiging om te associëren met kalium in zijn mineralen, het vinden van onzuiverheden. Niet alleen in geochemische materie vormt een duo met kalium, maar ook op het gebied van biochemie.
Het organisme "verwart" de kionen+ Voor die van RB+; Rubidio is echter tot nu toe geen essentieel element, omdat het onbekend is welke rol hij speelt in het metabolisme. Toch zijn rubidium supplementen gebruikt om bepaalde medische aandoeningen zoals depressie en epilepsie te verlichten. Aan de andere kant schieten beide ionen een violette vlam in de hitte van de aansteker.
Vanwege de hoge kosten zijn de toepassingen niet te veel gebaseerd op de synthese van katalysatoren of materialen, maar als een component voor verschillende apparaten met fysieke theoretische basen. Een van hen is de atoomklok, zonnecellen en magnetometers. Daarom wordt het rubidium soms genomen als een onderschat of weinig bestudeerd metaal.
[TOC]
Geschiedenis
De rubidio werd in 1861 ontdekt door Duitse chemici Robert Bunsen en Gustav Kirchhoff, met behulp van spectroscopie. Om dit te doen, gebruikten ze de Bunsen -lichter en de spectroscoop, twee jaar eerder uitgevonden, naast analytische neerslagtechnieken. Het studieobject was het Lepidolite -mineraal, wiens de verzameling Saksen, Duitsland toont.
Ze begonnen vanaf 150 kg lepidoliet mineraal, die ze behandelden met chloroplatinezuur, h2PTCL6, Om het kalium hexacloroplatinaat te neerslaan, k2PTCL6. Toen ze echter hun spectrum bestudeerden door het in de Bunsen -lichter te verbranden, realiseerden ze zich dat ze emissielijnen vertoonden die niet samenvielen tegen die tijd met enig ander element.
Het emissiespectrum van dit nieuwe element wordt gekenmerkt door twee goed gedefinieerde lijnen in de rode regio te hebben. Daarom werd hij gedoopt met de naam 'rubidus', wat 'donkere rood' betekent. Toen slaagden Bunsen en Kirchhoff erin de RB te scheiden2PTCL6 van K2PTCL6 door gefractioneerde kristallisatie; Om het eindelijk te verminderen tot uw chloridezout met behulp van waterstof.
Geïdentificeerd en geïsoleerd van een zout van het nieuwe rubidio -element, Duitse chemici hoefden alleen om het te verminderen tot hun metalen toestand. Om dit te bereiken, probeerden ze op twee manieren: breng elektrolyse aan op rubidiumchloride of verwarm een gemakkelijk zout om te verminderen, zoals Tartrato. Zo werd de metalen rubidio geboren.
Fysische en chemische eigenschappen
Verschijning
Zilvergrijs metaal. Het is zo zacht dat het eruit ziet als een boter. Het wordt meestal verpakt in glazen ampullen, waarbinnen een inerte atmosfeer overheerst die het beschermt tegen het reageren met lucht.
Atoomnummer (z)
37
Molaire massa
85,4678 g/mol
Smeltpunt
39 ºC
Kookpunt
688 ºC
Dikte
Bij kamertemperatuur: 1.532 g/cm3
Op het smeltpunt: 1,46 g/cm3
De dichtheid van het rubidium is superieur aan die van water, dus het zal zinken terwijl hij er gewelddadig mee reageert.
Fusiewarmte
2.19 kJ/mol
Verdampingswarmte
69 kJ/mol
Elektronegativiteit
0,82 op de Pauling -schaal
Elektronische affiniteit
46,9 kJ/mol
Ionisatie -energieën
-Eerst: 403 kJ/mol (RB+ gasvormig)
-Ten tweede: 2632.1 kJ/mol (RB2+ gasvormig)
-Derde: 3859,4 kJ/mol (RB3+ gasvormig)
Atomaire radio
248 PM (empirisch)
Warmtegeleiding
58.2 w/(m · k)
Elektrische weerstand
128 nω · m bij 20 ° C
Mohs hardheid
0,3. Daarom is zelfs talk moeilijker dan metallic rubidium.
Reactiviteit
 Vlamrepetitie voor rubidium. Als hij reageert, neemt hij afscheid van een violette vlam. Bron: Didaktische.Medien [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Vlamrepetitie voor rubidium. Als hij reageert, neemt hij afscheid van een violette vlam. Bron: Didaktische.Medien [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Rubidio is een van de meest reactieve alkalische metalen, na Cesio en Francio. Hij wordt nauwelijks blootgesteld aan de lucht begint te branden, en als hij holvol is, schiet hij lichtgevende vonken. Als hij wordt verwarmd, zendt hij ook een violette vlam (superieure afbeelding) uit, wat een positieve test is voor RB -ionen+.
Kan u van dienst zijn: ididio 192Reageert met zuurstof om een mengsel van peroxiden te vormen (RB2OF2) en superoxiden (RBO2)). Hoewel het niet reageert met zuren en basen, schendt het het wel met water, waardoor rubidium- en waterstofgashydroxide wordt gegenereerd:
Rb (s) + h2Of (l) => rboh (ac) + h2(G)
Reageert met waterstof om de overeenkomstige hydride te vormen:
Rb (s) + h2(g) => 2rbh (s)
En ook met halogenen en zwavel explosief:
2rb (s) + Cl2(g) => rbcl (s)
2rb (s) + s (l) => rb2H.H)
Hoewel rubidium niet als een giftig element wordt beschouwd, is het potentieel gevaarlijk en vertegenwoordigt het brandrisico's wanneer het in contact komt met water en zuurstof.
Elektronische structuur en configuratie
Rubidio -atomen zijn zo gerangschikt dat ze een kubieke structuur kristal in het lichaam vaststellen (BCC). Deze structuur is kenmerkend voor alkalische metalen, die licht zijn en de neiging hebben om over water te drijven; Behalve het rubidium down (cesio en francio).
In Rubidio BCC -kristallen interageren hun RB -atomen met elkaar dankzij de metalen link. Dit wordt bepaald door een "zee van elektronen" van zijn valentielaag, van de 5s orbital volgens zijn elektronische configuratie:
[KR] 5S1
Alle 5s orbitalen met hun enige elektron zijn overlappen in alle afmetingen van Rubidio metaalkristallen. Deze interacties zijn echter zwak, omdat naarmate de groep alkalische metalen afstammen, de orbitalen diffuus worden en daarom verzwakt het metaalverbinding verzwakt.
Daarom is het smeltpunt van het rubidium 39 ºC. Ook verklaart de zwakke metaalbinding de zachtheid van zijn vaste stof; zo zacht dat het een zilveren boter lijkt te zijn.
Er is niet genoeg bibliografische informatie over het gedrag van hun kristallen onder hoge druk; Als er dichtste fasen zijn met unieke eigenschappen zoals bij natrium.
Oxidatienummers
De elektronische configuratie geeft ooit aan dat het rubidium sterk zijn enige elektron verliest om isolectronisch tot edelgas Kripton Gas te worden. Als dat zo is, wordt het monovalente kation gevormd RB+. Er wordt gezegd dat het in zijn verbindingen oxidatienummer +1 heeft wanneer het bestaan van dit kation wordt aangenomen.
Vanwege de trend van het rubidium om te oxideren, de veronderstelling dat er RB -ionen zijn+ In zijn verbindingen is het succesvol, wat op zijn beurt het ionische karakter van deze verbindingen opmerkt.
In bijna alle verbindingen van het rubidium vertoont dit een oxidatienummer van +1. Voorbeelden van hen zijn de volgende:
-Rubid -chloride, rbcl (RB+Klet-))
-Rubidio Hydroxide, RBOH (RB+ Oh-))
-Rubidio Carbonate, RB2CO3 (RB2+CO32-))
-Rubidio monoxide, RB2Of (RB2+OF2-))
-Rubidium superoxide, rbo2 (RB+OF2-))
Zelfs als het zeer zeldzaam is, kan het rubidium ook een negatief oxidatienummer hebben: -1 (RB-)). In dit geval zouden we het hebben over een "rubidiuro" als hij een samenstelling vormde met een minder elektronegatief element dan hij, of als hij onder speciale en rigoureuze omstandigheden werd ingediend.
Clusters
Er zijn verbindingen waarbij elk RB -atoom oxidatienummers heeft met fractionele waarden. Bijvoorbeeld in RB6Of (RB62+OF2-) en RB9OF2 (RB94+OF22-) De positieve belasting wordt verdeeld over een set RB -atomen (clusters). Dus in de RB6Of het oxidatienummer in theorie zou +1/3 zijn; Terwijl in RB9OF2, + 0.444 (4/9).
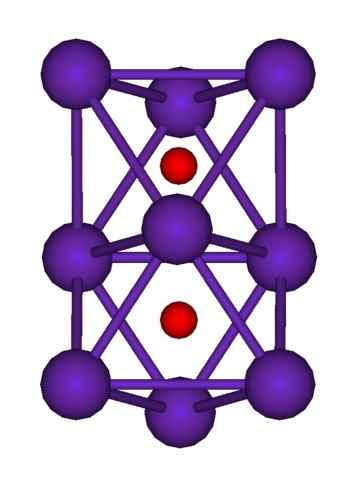 RB9O2 -clusterstructuur. Bron: Axiosaurus [Public Domain]
RB9O2 -clusterstructuur. Bron: Axiosaurus [Public Domain] De RB -clusterstructuur wordt hierboven weergegeven9OF2 vertegenwoordigd door een bollen en barsmodel. Merk op hoe de negen RB -atomen de anionen "omsluiten" of2-.
Bij wijze van elucubratie is het alsof een deel van de originele metalen kristallen van het rubidium ongewijzigd bleef tijdens het scheiden van het moederkristal. Ze verliezen daarbij elektronen; die nodig zijn om de OK aan te trekken2-, en de resulterende positieve lading wordt verdeeld over alle atomen van genoemde cluster (set of aggregaten van RB -atomen).
In deze rubidiumclusters kan het bestaan van RB dus niet formeel worden aangenomen+. De RB6Of en RB9OF2 Ze classificeren als rubidium -suboxiden, waarin deze schijnbare afwijking is vervuld om een overmaat metaalatomen te hebben in relatie tot oxidenanionen.
Waar is het en verkrijgt
aardkorst
 Lepidolite mineraalmonster. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Lepidolite mineraalmonster. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Rubidio is het meest voorkomende element 23 van de aardkorst, met een overvloed vergelijkbaar met die van zink-, lood-, cesium- en koperen metalen. Het detail is dat hun ionen breed worden verspreid, dus het overheerst niet in een mineraal als een belangrijk metaalelement, en hun ertsen zijn ook schaars.
Kan u van dienst zijn: Grignard -reagens: voorbereiding, toepassingen, voorbeeldenHet is om deze reden dat Rubidio een zeer duur metaal is, zelfs meer dan hetzelfde goud, omdat het proces van het verkrijgen van zijn mena's complex is vanwege de moeilijkheid van zijn uitbuiting.
In de natuur, gezien zijn reactiviteit, bevindt Rubidium zich niet in een native staat, maar als oxide (RB2O), chloride (RBCL) of vergezeld van andere anionen. Zijn "gratis" RB -ionen+ Ze zijn in de zeeën met een concentratie van 125 µg/l, evenals in de warmwaterbronnen en rivieren.
Onder de mineralen van de korst van de aarde die het in een concentratie van minder dan 1% bevatten die we hebben:
-Leucita, K [Alsi2OF6]
-Polucita, CS (ja2Hallo6· NH2OF
-SARNALITA, KMGCL3· 6h2OF
-Zinnwaldita, klifeal (Alsi3)OF10(Oh, f)2
-Amazonita, PB, Kalsi3OF8
-Petalita, Lialsi4OF10
-Biotita, K (Mg, Faith)3Alsi3OF10(Oh, f)2
-Rubiclina, (rb, k) Alsi3OF8
-Lepidolita, K (Li, AL)3(Ja, al)4OF10(F, OH)2
Geochemische associatie
Al deze mineralen delen een of twee dingen gemeen: het zijn kalium-, cesium- of lithiumsilicaten, of zijn minerale zouten van deze metalen.
Dit betekent dat Rubidio een sterke neiging heeft om te associëren met kalium en cesio; Het kan zelfs kalium vervangen tijdens de kristallisatie van mineralen of rotsen, zoals het gebeurt in de velden van de pegmatitas wanneer het magma kristalliseert. Rubidio is dus een bijproduct van de exploitatie en het verfijnen van deze rotsen en hun mineralen.
Rubidio kan ook in gewone rotsen zijn zoals graniet, klei en basalt, en zelfs carbonaatafzettingen. Van alle natuurlijke bronnen vertegenwoordigt lepidoliet zijn hoofderts en waaruit het commercieel wordt uitgebuit.
In de Scannalite daarentegen kan Rubidio worden gevonden als RBCL -onzuiverheden met een inhoud van 0,035%. En in grotere concentratie zijn er de afzettingen van polucitas en rubiclinas, die tot 17% van Rubidium kunnen hebben.
De geochemische associatie met kalium is te wijten aan de gelijkenis van zijn ionische radio's; De RB+ is groter dan k+, Maar het verschil in maten is geen belemmering voor het eerste om de tweede in zijn minerale kristallen te vervangen.
Fractionele kristallisatie
Of het nu is gebaseerd op lepidoliet of polucita, of een van de hierboven genoemde mineralen, de uitdaging blijft hetzelfde in meer of mindere mate: het scheiden van het rubidium van het kalium en de cessium; dat wil zeggen, breng mengscheidingstechnieken aan die de verbindingen of zouten van rubidium enerzijds, en die van kalium en cesium, anderzijds mogelijk maken.
Dit is moeilijk omdat deze ionen (k+, RB+ en CS+) een geweldige chemische gelijkenis delen; Ze reageren op dezelfde manier om dezelfde zouten te vormen, die nauwelijks van elkaar verschillen dankzij hun dichtheden en oplosbaarheid. Daarom wordt gefractioneerde kristallisatie gebruikt, zodat ze langzaam en gecontroleerd kunnen.
Deze techniek wordt bijvoorbeeld gebruikt om een mengsel van carbonaten en alums van deze metalen te scheiden. Herkristallisatieprocessen moeten verschillende keren worden herhaald om ultieme en vrije kristallen van coprecipiteerde ionen te garanderen; Een rubidiumzout dat kristalliseert met kionen+ of CS+ op het oppervlak of binnen.
Meer moderne technieken, zoals het gebruik van een ionenuitwisselingshars of kronen als complexe agenten, staan ook RB -ionen toe+.
Elektrolyse of reductie
Zodra het mogelijk was om het rubid -zout te scheiden en te zuiveren, is de volgende en laatste stap om de kationen RB te verminderen+ naar massief metaal. Om dit te doen, smelt het zout en wordt het onderworpen aan elektrolyse om rubidium in de kathode neer te slaan; of een sterk reductiemiddel, zoals calcium en natrium, wordt gebruikt, in staat om snel elektronen te verliezen en dus de rubidium te verminderen.
Isotopen
Rubidio wordt op aarde gevonden als twee natuurlijke isotopen: de 85RB en 87RB. De eerste heeft een overvloed van 72,17%, terwijl de tweede van 27,83%.
Hij 87RB is verantwoordelijk voor dit metaal dat radioactief is; De straling ervan is echter onschadelijk en zelfs gunstig voor dating -analyse. Uw halfwaardetijd (T1/2) is 4,9 · 1010 jaren, wiens tijdsperiode de leeftijd van het universum overschrijdt. Wanneer het vervalt, wordt het de stabiele isotoop 87Dhr.
Dankzij dit is deze isotoop gebruikt om de leeftijd van mineralen en landrotsen aanwezig te zijn sinds het begin van de aarde.
Naast de isotopen 85RB en 87RB, er zijn andere synthetische en radioactief met variabele en veel kortere levensduur; Bijvoorbeeld hem 82RB (T1/2= 76 seconden), 83RB (T1/2= 86,2 dagen), 84RB (T1/2= 32,9 dagen) en 86RB (T1/2= 18,7 dagen). Van allemaal, de 82RB is het meest gebruikt in medische studies.
Risico's
Metaal
Rubidio is een metaal dat zo reactief is dat het moet worden bewaard in glazen ampullen onder een inerte atmosfeer zodat het niet reageert met de zuurstof van de lucht. Als deze ampoule breekt, kan het metaal in kerosine of minerale olie worden geplaatst om het te beschermen; Het zal echter de opgeloste zuurstof erin oxideren, wat aanleiding geeft tot rubidiumperoxiden.
Het kan u van dienst zijn: natriumcyanide (NACN): structuur, eigenschappen, risico's, gebruikAls integendeel werd besloten om het op hout te plaatsen, zal het uiteindelijk branden met een violette vlam. Als er veel vocht is, zal het branden met alleen het feit dat het aan de lucht wordt blootgesteld. Wanneer een groot stuk rubidium wordt vermeden bij een volume water, maakt het krachtig exploitatie en bereikt het met waterstof geproduceerde gas in brand.
Daarom is rubidium een metaal dat moet manipuleren, omdat alle reacties praktisch explosief zijn.
Ionen
In tegenstelling tot metallic rubidium, zijn RB -ionen+ Ze vormen geen duidelijk risico op levende wezens. Deze opgelost in water interageren met de cellen op dezelfde manier als de k -ionen doen+.
Daarom hebben rubidium en kalium vergelijkbaar biochemisch gedrag; Rubidium is echter geen essentieel element, terwijl kalium ja. Op deze manier, aanzienlijke hoeveelheden RB+ Ze kunnen zich ophopen in het interieur van de cellen, rode bloedcellen en ingewanden zonder een negatieve invloed op het lichaam van elk dier.
In feite is geschat dat een volwassen man met een massa van 80 kg ongeveer 37 mg rubidio bevat; En dat bovendien een toename van deze concentratie in de volgorde van 50 tot 100 keer niet leidt tot ongewenste symptomen.
Echter, een overtollige RB -ionen+ kan uiteindelijk naar K -ionen verhuizen+; En bijgevolg zal het individu tot de dood zeer sterke spierspasmen lijden.
Logisch gezien kunnen salvorzouten of verbindingen van rubidium dit onmiddellijk activeren, dus geen van hen moet worden ingenomen. Bovendien kan het eenvoudige contactbrandwonden veroorzaken en een van de meest toxische fluoride (RBF), hydroxide (RBOH) en cyanide (rbcn) van rubidium.
Toepassingen
Gasverzamelaar
Rubidio is gebruikt om de sporen van gassen te vangen of te elimineren die kunnen bestaan in de vacuümafgegelezen buizen. Juist vanwege hun hoge neiging om zuurstof en vocht erin te vangen, elimineren ze ze op hun oppervlak als peroxiden.
Pyrotechniek
Wanneer rubidio zouten een karakteristieke violet-rode vlam verbranden. Sommige vuurwerk heeft deze zouten in hun compositie, zodat ze exploderen met deze kleuren.
Supplement
Rubidio -chloride is voorgeschreven om depressie te bestrijden, aangezien studies een tekort van dit element hebben bepaald bij personen die aan deze medische toestand lijden. Het is ook gebruikt als een kalmerend middel en om epilepsie te behandelen.
Bose-Einstein condensaat
De isotoopatomen 87RB werd gebruikt om het eerste Bose-Einstein-condensaat te creëren. Deze toestand van materie is dat atomen bij een temperatuur vrij dicht bij absolute nul (0 k) zijn gegroepeerd of "condensan", zich gedragen alsof ze er één zijn.
De rubidio was dus de hoofdrolspeler van deze triomf op het gebied van natuurkunde, en het was Eric Cornell, Carl Wieman en Wolfgang Ketterle die in 2001 de Nobelprijs ontvingen dankzij dit werk.
Tumormiagnose
De synthetische radio -isotoop 82RB vervalt door positrones uit te zenden, die wordt gebruikt om zich op te hopen in kalium -rijke weefsels; Zoals die in de hersenen of het hart. Het wordt daarom gebruikt om de functionaliteit van het hart en de aanwezigheid van mogelijke tumoren in de hersenen te analyseren door positronemissietomografie.
Onderdeel
Rubidio -ionen hebben ruimte gevonden in verschillende soorten materialen of mengsels. Hun legeringen met goud, cesium, kwik, natrium en kalium zijn bijvoorbeeld gemaakt. Het is waarschijnlijk aan glas en keramiek toegevoegd om hun smeltpunt te vergroten.
In perovskitas zonnecellen zijn ze toegevoegd als een belangrijk onderdeel. Evenzo is het mogelijke gebruik ervan bestudeerd als thermo -elektrische generator, warmtetransmissiemateriaal in de ruimte, brandstof in ionische voortstuwingsmotoren, elektrolytisch medium voor alkalische batterijen en atoommagnetometers.
Atomaire horloges
Met rubidium en stoptjes zijn de beroemde atoomhorloges vervaardigd, zeer nauwkeurig, bijvoorbeeld gebruikt in GPS -satellieten waarmee de eigenaren van hun smartphones hun locatie kunnen kennen terwijl ze op een weg gaan.
Referenties
- Bond Tom. (29 oktober 2008). Rubidium. Hersteld van: chemieworld.com
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Rubidium. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). Rubidium. PubChem -database. CID = 5357696. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Chellan, p., & Sadler, p. J. (2015). De elementen van het leven en medicijnen. Filosofische transacties. Serie A, Mathematical, Physical and Engineering Sciences, 373 (2037), 20140182. Doi: 10.1098/rsta.2014.0182
- May Foundation for Medical Education and Research. (2019). Rubidium RB 82 (intraveneuze route). Hersteld van: mayoclinic.borg
- Marques Miguel. (S.F.)). Rubidium. Hersteld van: nautilus.Fis.UC.PT
- James L. Verven. (12 april 2019). Rubidium. Encyclopædia Britannica. Hersteld van: Britannica.com
- Dr. Doug Stewart. (2019). Rubidium -elementenfeiten. Chemicool. Hersteld van: chemicool.com
- Michael Pilgaard. (10 mei 2017). Rubidium chemische reacties. Hersteld van: PilgaAardelegs.com
- « Tuskegee Experiment geschiedenis, motieven en kritiek
- Malacologiegeschiedenis, praktijken, onderzoek »

