Reductie (chemie)
- 2329
- 250
- James Dach
 Zilverboomreductie. Bron: Gabriel Bolívar
Zilverboomreductie. Bron: Gabriel Bolívar Wat is de reductie?
De afname Het is al die chemische reactie waarbij de atomen van een van de reagentia uiteindelijk elektronen winnen, die ook op deze manier kunnen worden gezien: de vacature of elektronische "ongemak" wordt verminderd. Een atoom krijgt elektronen wanneer een soort ze doneert, dat wil zeggen wanneer geoxideerd.
Dit type reactie kan niet op zichzelf worden gegeven: als een soort elektronen accepteert, moet een ander hem noodzakelijkerwijs geven. Anders zou materie vanuit niets worden gecreëerd, waardoor atomen worden verminderd na het verkrijgen van lege elektronen. Daarom is het een redox semi -licht (reductie/oxidatie).
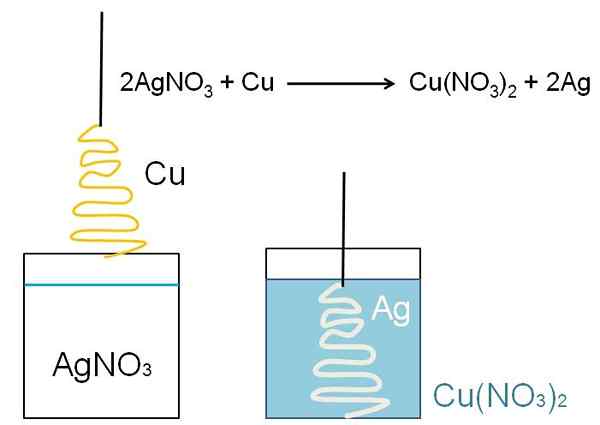
Een illustratief voorbeeld van de reductie die kan worden getoond in klaslokalen is de reactie tussen een metalen koperoppervlak en een waterige zilvernitraatoplossing, agno3.
In de oplossing is zilver als kationen ag+, positief geladen. Deze zijn, bij interactie met het oppervlak van het koper, in de vorm van kerstboom, de elektronen uit koperatomen gehaald. Wanneer dit gebeurt, vervangt koper zilver in nitraatzout, en als gevolg daarvan wordt kopernitraat gevormd, nee3))2.
Cu -kationen2+ Naast nee3- Ze blazen de oplossing en het zilver belichaamt de kerstboom alsof ze deze bedekken met sneeuw.
Wat is de reductie?
In de reductie is al gezegd dat een soort elektronen wint. Hoe kan dit worden gecontroleerd in een chemische vergelijking? Bijvoorbeeld in de reactievergelijking tussen Cu en Agno3, Hoe te weten wanneer de reductie optreedt? Om het te verifiëren, is het noodzakelijk om het aantal of de oxidatiestatus te bepalen.
Kan u van dienst zijn: elektronegativiteitDe elementen, in hun natuurlijke toestanden, hebben als definitie een staat van oxidatie gelijk aan nul, omdat wordt aangenomen dat ze geen elektronen hebben verloren of gewonnen. Aldus heeft vaste metalen nul oxidatietoestand. Aldus passeert zilver van +1 (Ag+) A 0 (Ag). De belasting van een metaalion is gelijk aan de oxidatietoestand.
Aan de andere kant kwamen de elektronen uit koper: verplaatsen van 0 (Cu) naar +2 (Cu2+)). Het nitraatanion, nee3- blijft onveranderlijk, terwijl beide metalen elektronen uitwisselen. Daarom kan de vergelijking worden geschreven als:
2ag+ + Cu => 2ag + cu2+
Merk op dat zowel belastingen als atomen in evenwicht zijn.
Dit bestaat uit de chemische reductie: in de versterking van elektronen die de oxidatietoestanden maken van de atomen die de elektronen minder positief verdienen.
Aantal zuurstof
Zuurstof zijn zeer elektronegatieve en oxiderende atomen, dus wanneer een atoomvorm samengewerkt (zoals oxiden), hebben ze positieve oxidatietoestanden. Hoe groter het aantal zuurstof dat interactie aangaat met het atoom, hoe positiever zijn oxidatie zal zijn. Of wat hetzelfde is, het is meer geoxideerd.
Daarom, wanneer een verbinding minder zuurstofatomen heeft, wordt gezegd dat deze minder geoxideerd is. Dat wil zeggen, het atoom verliest minder elektronen.
Een klassiek voorbeeld is te zien in monoxide en koolstofdioxide. Voor CO heeft koolstof een oxidatietoestand van +2, terwijl voor Co₂ de oxidatiestatus zijn +4 is.
Dus als de co₂ in een reactie wordt getransformeerd naar CO, wordt gezegd dat er een reductie plaatsvindt, omdat de koolstof nu interactie heeft met een zuurstof en niet twee. Voor de tegenovergestelde reactie, co -transformerend, is er sprake van een oxidatie van koolstof.
Kan u van dienst zijn: ferro chloride (FECL2): structuur, gebruik, eigenschappenDit geldt voor alle atomen, vooral metalen in hun metaaloxiden. Bijvoorbeeld Cro2 (Cr4+) en Cro3 (Cr6+)).
In chemische vergelijkingen, waarbij een soort zuurstof verliest terwijl de andere soort het verdient, wordt gezegd dat er een zuurstofoverdracht plaatsvindt.
Elektronegatief atoom
Het kan altijd worden bepaald als er een reductie was door de oxidatiestatus te wijzigen in een minder positieve waarde. Zoals je zojuist hebt uitgelegd, is een snelle manier om het op te merken zonder zelfs de berekeningen te maken waarnemen of er een afname van zuurstofatomen in een verbinding is.
Hetzelfde kan gebeuren met elk ander atoom dat meer elektronegatief is dan het atoom dat elektronen wint of verliest.
Bijvoorbeeld als de CF4 reageert op zo'n manier dat het cho wordt4, Er wordt dan gezegd dat er een reductie is opgetreden, omdat fluoride veel elektronegatief is dan waterstofatoom. Als gevolg hiervan is koolstof minder geoxideerd in Cho4 dat in de CF4, wat hetzelfde is om te zeggen dat het is verminderd.
Voorbeelden
Vermindering van de organische chemie
Het voorbeeld van de CF4 en ch4 weerspiegelt wat er gebeurt in organische reacties, waarbij de reductie van de gedeeltelijke belasting van een atoom wordt beschouwd als elektronische versterking. Dit geldt enorm bij het overwegen van de vermindering van geoxygeneerde functionele groepen.
Overweeg bijvoorbeeld de groepen ROH, RCHO en COOH. De eerste komt overeen met alcoholen, waarbij koolstof is gekoppeld aan zuurstof (C-OH); De tweede is de aldehyde-groep, waarbij koolstof zich dubbele binding vormt met zuurstof en ook is gekoppeld aan een waterstof (C = O-H), en de derde is de carboxylgroep.
Kan u van dienst zijn: berylhydroxide (be (oh) 2)In de carboxylgroep vormt koolstof een dubbele binding met een O en een eenvoudige link met een andere O (HO-C = O).
Daarom treedt een reductie op als een carbonzuur wordt omgezet in een alcohol:
RCOOH => ROH
Metaalextractie
Chemische reductie is uiterst belangrijk bij metaalextractieprocessen van hun mineralen. Sommige reacties zijn:
HGS + O2 => Hg + dus2
Kwiksulfide wordt gereduceerd tot metalen kwik.
Cu2S + O2 => 2cu + dus2
Kopersulfide tot metaalkoper is verminderd.
2zns + 3o2 => 2zno + 2So2
ZnO + C => Zn + Co (let op de overdracht van O).
Zinksulfide wordt eerst gereduceerd tot zijn monoxide en vervolgens tot zijn metalen vorm.
Vertrouwen2OF3 + 3co => 2fe + 3co2
IJzeroxide wordt gereduceerd tot metaalachtig ijzer.
Wo3 + 3H2 => W + 3H2OF
En Tungsten -trioxide is gereduceerd tot metalen wolfraam.
Als oefening kan het oxidatienummer van het metaal worden bepaald voordat het wordt gereduceerd.
Andere voorbeelden
- IJzerion (III) kan worden gereduceerd tot ijzer (II):
- Etino kan worden gereduceerd tot Eteno:
- Etanal kan worden gereduceerd tot ethanol
Referenties
- Oxidatie-reductiereacties. Chem hersteld.Librhetxts.borg.
- De definitie van vermindering van de chemie. Hersteld van ThoughtCo.com.




