Exotherme reactie
- 4209
- 474
- Dewey Powlowski
We leggen uit welke exotherme reacties, hun kenmerken, verschillen met endothermische reacties zijn en geven verschillende voorbeelden
Wat zijn exotherme reacties?
De exotherme reacties Het zijn chemische reacties die energie vrijgeven in de vorm van warmte. Het exotherme woord wordt gevormd door "Exo" wat "uit" betekent, en "thermosfles" wat betekent dat warmte, dus "exotherme reactie" betekent letterlijk de reactie waarbij warmte uitgaat.
Deze reacties zijn heel gebruikelijk en we kunnen ze overal vinden, van onze huizen tot de cellen die deel uitmaken van ons lichaam.
Thuis kunnen we ze in de keuken vinden wanneer het gas in de hoorn brandt om ons eten te koken. We vinden ze ook in automotoren wanneer ze brandstof verbranden.
 Een voorbeeld van exotherme reactie
Een voorbeeld van exotherme reactie Aan de andere kant zijn exotherme reacties essentieel voor het leven, omdat ze cellen voorzien van de energie die ze nodig hebben om te leven, te groeien en zich voort te planten.
Kenmerken van exotherme reacties
Ze geven energie vrij in de vorm van warmte
Dit is het belangrijkste kenmerk dat hen exotherme reacties maakt.
De vrijgegeven energie komt van dezelfde reagentia
Elke chemische reactie vereist dat er enige activeringsenergie opkomt. In het geval van exotherme reacties komt deze energie uit dezelfde reagentia wanneer ze worden omgezet in producten.
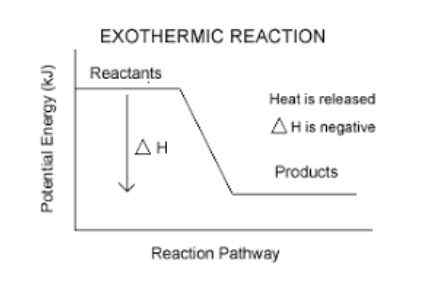
Exotherme reacties zijn altijd stabieler dan reagentia.
De reagentia door producten te worden, een deel van hun energie verliezen in de vorm van warmte. Om deze reden blijven producten altijd met minder energie dan reagentia, waardoor ze stabieler worden.
Ze hebben een negatieve enthalpie -variatie.
Dit is een gemakkelijke manier om te weten of een reactie exotherme is of niet. Elke reactie met een AH (lees delta h) negatief, zal exotherme zijn.
- Bijvoorbeeld, De verbrandingsreactie van de butaan (het gas dat we in de keuken verbranden) heeft een enthalpie -variatie van -11.823 kcal/mol. Daarom is het een exotherme reactie.
Ze hebben in de meeste gevallen alleen een trigger nodig.
Veel exotherme reacties hebben alleen iets nodig dat hen voldoende energie geeft om te beginnen. Hierna is dezelfde hitte die ze vrijgeven voldoende om de reactie te laten lopen.
- Bijvoorbeeld, Door gas te verbranden, is er slechts één vonk nodig, dan blijft de vlam ingeschakeld totdat het gas voorbij is.
Verschillen tussen exotherme reacties en endotherme reacties
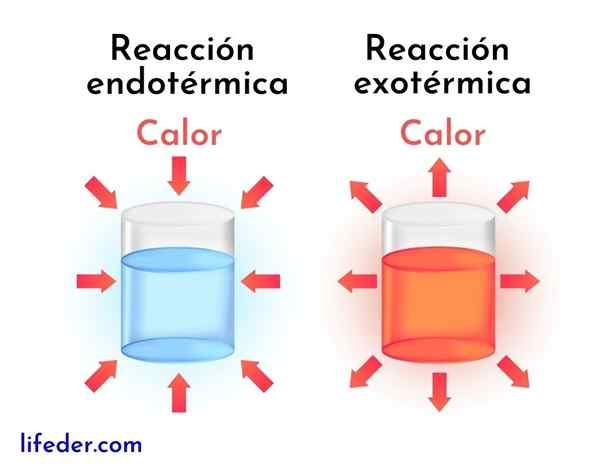
Exotherme reacties zijn het tegenovergestelde van endotherme reacties. In dit laatste absorberen reagentia energie in de vorm van warmte in plaats van het vrij te geven, zoals bij exotherme reacties.
Vervolgens worden de belangrijkste verschillen tussen exotherme en endotherme reacties gepresenteerd:
Exotherme reacties | Endotherme reacties |
Ze geven energie vrij in de vorm van warmte. | Ze absorberen energie in de vorm van warmte. |
Ze hebben een negatieve enthalpie variatie, dat is DH<0. | Ze hebben een positieve enthalpie -variatie, dat is dh> 0. |
Ze hebben de neiging om de omringende temperatuur te verhogen. | Ze hebben de neiging om de temperatuur te verlagen of af te koelen. |
De energie die de reactie loopt, komt van dezelfde reagentia. | De energie die de reactie loopt, komt uit de omgeving. |
Stabielere producten worden altijd verkregen met minder energie. | Minder stabiele producten worden altijd verkregen met een hoger energieniveau. |
Voorbeelden van exotherme reacties
De verbranding van keukengas
In de meeste huizen ter wereld is het gas dat wordt gebruikt om voedsel te koken Butaan, dat de moleculaire formule heeft C4H10. Deze koolwaterstof wordt verbrand met de zuurstof van de lucht door middel van de volgende verbrandingsreactie die grote hoeveelheden warmte vrijgeeft:
Kan u van dienst zijn: eenvoudige microscoop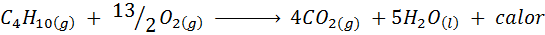
De explosie van dynamiet
Dynamiet bevat een explosief genaamd nitroglycerine (c3H5N3OF9)). Deze verbinding ontbindt zeer gewelddadig grote hoeveelheden warmte, wat een grote explosie veroorzaakt. De chemische reactie is:
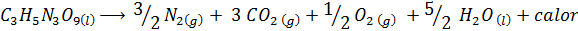
Deze reactie heeft een ΔH = -368 kcal⁄mol, Het is dus een exotherme reactie.
Spontane verbranding van witte fosfor
Het fosforelement (P) kan worden gevonden als rode fosfor of witte fosfor. Witte fosfor. De reactie is:
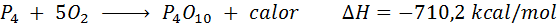
Cellulaire ademhaling
Cellulaire ademhaling is een exotherme chemische reactie die bestaat uit de oxidatie van het voedsel dat we eten. De warmte die door deze reactie wordt afgegeven, wordt door cellen gebruikt om eindeloze endotherm chemische reacties uit te voeren die vereisen dat energie opkomt.
Vuurwerk
Vuurwerk bevat zwarte buskruit als de belangrijkste explosieve component. Buskruit is een mengsel dat kaliumnitraat, grafiet en zwavelkoolstof bevat die met elkaar reageren door een exotherme reactie. De warmte die deze reactie vrijgeeft, genereert het brede scala aan kleuren dat we in de hemel zien wanneer vuurwerk explodeert.
Het chemische thermische pad
Thermische pads worden gebruikt als hete kompressen om sportletsels te verlichten. Deze bestaan uit een afgesloten zak met water en een chemicus in een kleine buis. Wanneer de buis wordt verbroken, wordt de chemicus gemengd met het water dat een exotherme chemische reactie produceert die het kussen verwarmt.
Metallische natriumreactie met water
Natrium (NA) is een zeer reactief alkalisch metaal dat wanneer in contact komt met water reageert gewelddadig veel warmte en gasvormige waterstof. De reactie is:
Het kan u van dienst zijn: methoden voor scheiding van heterogene mengsels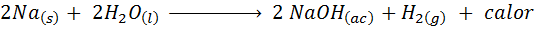
Deze reactie geeft 1900 calorieën vrij voor elke gram NA die reageert met water. Dit betekent dat 1 gram natrium voldoende zou zijn om 3 middelgrote koffiekopjes te verwarmen.
Wasmiddelenoplossing
Dit is een reactie die iedereen thuis kan ervaren. Bij het nemen van een handvol wasmiddel om kleding te wassen en nat te maken met een beetje water, zal de hand onmiddellijk heet aanvoelen. Dit komt omdat het oplossingsproces van het wasmiddel in water exotherm is.
De trimita -reactie
De termita is een mengsel van aluminium in de vorm van een zeer fijn poeder en een oxide van een ander metaalachtig ijzer. Na een vonk is de reactie die optreedt:
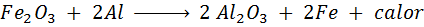
Deze reactie geeft zoveel warmte vrij, dat in staat is om ijzer te smelten en veel wordt gebruikt om treinrails te lassen.
Water -condensatie
Voor alle stoffen, gasfase -veranderingen (condensatie), vloeistof tot vaste (stolling) en vast gas (afzetting), geven altijd warmte vrij en zijn daarom exotherme processen. In het geval van water komt de condensatie van slechts 18 gram water uit ongeveer 10.000 calorieën, wat voldoende is om 15 kleine koffiekopjes te verwarmen.
Referenties
- Chang, R. en Goldsby, K. (2014). Scheikunde. 11e ed. New York: McGraw-Hill Education.
- Exotherme reactie (2020, 19 december). In Wikipedia. Genomen van.Wikipedia.borg
- Holmes, W. S. (1963). Warmte van verbranding van fosfor en de enthalpieën van de vorming van P4O10 en H3PO4. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada P. van een., F. Je. (2014). Vuurwerk, raketten en veel chemie. Chemisch onderwijs. 44-51. Doi: 10.2436/20.2003.02.134
- Thermietreactie. Universiteit van Minnesota (Afdeling Chemie). Genomen uit chem.Umn.Edu

