Synthesereactietypen, factoren, voorbeelden
- 3186
- 741
- Dewey Powlowski
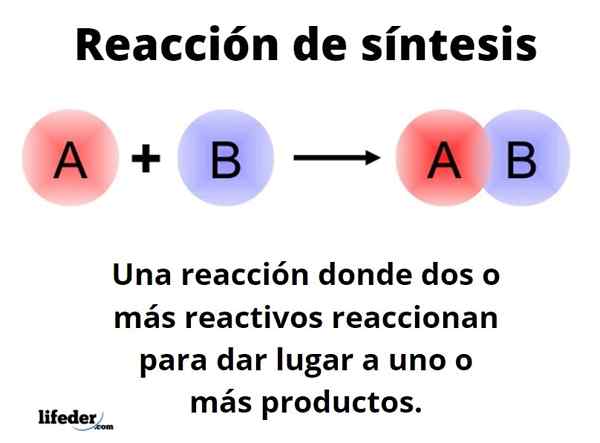
De Synthesiereactie Het is er een waarin twee of meer reagentia reageren om, kwantitatief, een of meer producten te kunnen ontstaan, hetzij op laboratorium- of industrieel niveau. Dit is een van de meest fundamentele reacties van chemie, en de soorten en ontwerpen grenzen aan bijna oneindig.
Generieke manier kan worden weergegeven met de vorm: A+B → C. In een eenvoudige synthesereactie reageert een reagens om met een ander B -reagens te reageren om een C -product te produceren. Er wordt gezegd dat het uit een enkele stap bestaat. Het kan echter gebeuren dat eerst reageert met E, gevolgd door F en uiteindelijk met G (andere reagentia), om te transformeren in product C; dat wil zeggen, dezelfde reactie vindt plaats in meerdere stappen.

Ongeacht een enkele stap of veel, zijn alle synthesereacties gebaseerd op effectiviteit (thermodynamica en kinetisch) waarmee reagentia reageren op transformeren in producten, evenals experimentele prestaties. Het is gewenst dat een synthesereactie succesvol passeert en zoveel mogelijk producten produceert.
[TOC]
Soorten synthesereacties
Eenvoudig of meervoudig
Synthesereacties zijn niet helemaal eenvoudig te classificeren. Het kan een probleem zijn met betrekking tot de criteria van de chemicus. Omdat? Stel dat de hierboven becommentarieerde reactie van meerdere reactie:
A + E → P1
P1 + F → P2
P2 + G → C
Zijn P1 En P2 tussenpersonen die niet van belang zijn. De reactie van productsynthese of verbinding C, beginnend bij een als belangrijkste reagens (beperkende of beperkende reagens), is meervoudig of complex, omdat het in verschillende stappen optreedt, waaraan andere reagentia deelnemen: E, F en G.
Elk van de vorige drie reacties kan bestaan en een soort chemische reactie op zichzelf. Dat wil zeggen, een synthesereactie kan van elk ander type chemische reacties zijn (dubbele verplaatsing, redox, verbranding, neutralisatie, nitratie, substitutie, enz.), zolang een product ontstaat en een experimentele prestatie heeft geassocieerd.
Dus:
A + E → P1
Het kan worden gezien als een eenvoudige synthesereactie voor product P1, ongeacht het type reactie dat is. En ook:
P1 + F → P2
Het is weer een eenvoudige synthesereactie voor product P2.
Anorganisch of organisch
Synthesereacties kunnen van welke aard dan ook zijn met betrekking tot de aard van de reactie en het moleculaire mechanisme ervan. Deze kunnen echter worden verdeeld volgens de chemische aard van reagentia en producten.
Kan u dienen: natriumacetaat: structuur, eigenschappen, synthese, gebruikAls reagentia bijvoorbeeld anorganische stoffen zijn, praten we over anorganische synthese; Hoewel het als ze organische stoffen waren, zouden we het al hebben over organische synthese.
Het gebied van organische synthese is kolossaal, omdat het de producties van medicijnen, kleurstoffen, kunststoffen, insecticiden, lijmen, parfums, conserveermiddelen, onder duizenden andere producten omvat.
Factoren die betrokken zijn bij synthesereacties
De factoren die betrokken zijn bij synthesereacties zijn al die parameters of variabelen, fysische en chemische stof, die direct de reactieprestaties en kwaliteit van de ontstane producten beïnvloeden. Sommigen van hen zijn de volgende:
Temperatuur
De temperatuur is essentieel bij elke synthesereactie. Afhankelijk van uw thermodynamica kan het handig zijn om laag of hoog te blijven. Evenzo zijn er temperaturen waar ongewenste laterale reacties waarschijnlijk zijn, dus het is essentieel om het te regelen en het te allen tijde te verifiëren.
Tijd
Tijd is ook essentieel bij synthesereacties, omdat het ervoor moet zorgen dat het voldoende is om de oprichting van het evenwicht te garanderen. Na een bepaalde tijd zal meer product ophouden te worden verkregen, en dat is wanneer wordt besloten de synthese volledig te stoppen.
Concentraties en kwaliteit van reagentia
Hoe meer geconcentreerd de reagentia zijn, hoe sneller de reacties zullen zijn. Het is echter ook essentieel om duidelijk te zijn over het aandeel van zijn concentraties, evenals de magnitudes, omdat de minimale verandering de uiteindelijke prestaties zal beïnvloeden.
Aan de andere kant moeten de reagentia zo puur mogelijk zijn, anders zullen onjuiste concentraties worden aangenomen; Of erger nog, de producten zullen worden besmet of ongewenste reacties zullen optreden.
Agitatie
De manier waarop het reactiemedium wordt geroerd, zal de rapides van synthesereacties beïnvloeden.
Druk
De druk, zoals concentratie, speelt een cruciale rol, vooral wanneer reagentia frisdranksoorten of stoffen zijn. Hoe groter de druk, hoe groter de botsingen of interacties tussen de reagentia en daarom zal er eerder reageren.
pH
De pH (zuur of basic) beïnvloedt rechtstreeks het mechanisme van een reactie, dus het is een sleutelfactor bij het definiëren van welke producten aan het einde van de synthese worden verkregen.
Kan u van dienst zijn: kookpunt: concept, berekening en voorbeeldenKatalysatoren
Katalysatoren zijn stoffen die chemische reacties versnellen, maar zonder te consumeren tijdens het proces. Er is een synthese dat het zonder uw interventie onmogelijk zou zijn.
Synthesereacties Voorbeelden
Vervolgens, en ten slotte, zullen chemische vergelijkingen voor synthesereacties van verschillende verbindingen worden aangehaald.
Tafelzout (natriumchloride)
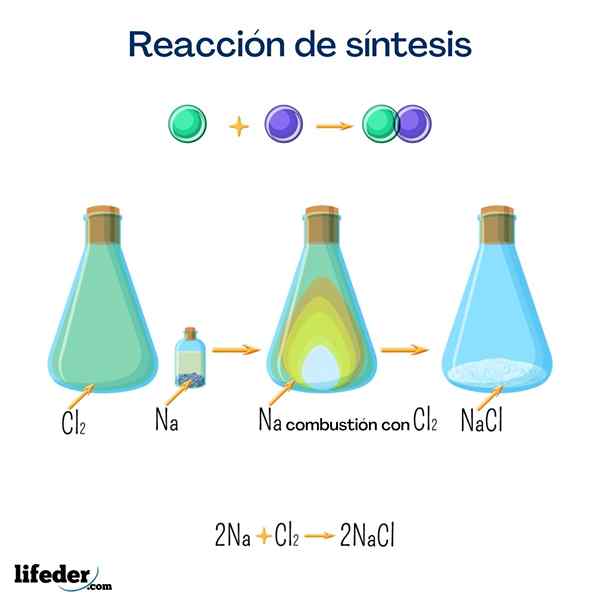
Dit zout is een van de bekendste bij iedereen vanwege zijn geweldige huishoudelijk gebruik. Het wordt verkregen uit natrium en chloor, en hoewel het kan worden verkregen door de volgende reactie is het heel gemakkelijk om het op natuurlijke wijze te vinden.
2 Na+Cl 2 → 2 NaClGlucose
Dit is een van de belangrijkste reacties voor het leven zoals we die kennen. Planten gebruiken koolstofdioxide en omgeving van het milieu met zonlicht om glucose en zuurstof te produceren.
De reactie op een zeer algemene manier is hieronder te zien, maar het is belangrijk om te begrijpen dat er daarachter verschillende reacties en mechanismen zijn om dit mogelijk te zijn.
6CO2 + 6H2O → C6H12O6 + O2
Sacharose
Deze synthesereactie treedt op in levende organismen en wordt gegeven bij het polymeriseren van glucose met fructose. Vanwege hun structuur interageren deze twee moleculen en het eindresultaat is sucrose en water, zoals te zien is in de volgende vergelijking:
C6H12O6 + C6H12O6 → C12H22O11 + H2O
Ammoniak
3 H2(g) + n2(g) → 2 NH3(G)
De reagentia h2 en N2 Ze zijn gasvormig. De druk moet hoog zijn om uw moleculen te reageren en de ammoniak te ontstaan, NH3. Dit is een van de belangrijkste synthesereacties van industriële chemie.
Water
2 H2(g) + of2(g) → 2 H2O (g)
De H2 I2 reageer exotherhisch om waterdamp te produceren. De hoeveelheid vrijgegeven energie is zodanig dat waterstof een van de meest veelbelovende brandstoffen is in ruimtevaarttoepassingen.
Alcohol
C2H4(g) + H2Of (l) → cho3Ch2Oh (L)
Ethanol staat bekend als alcohol en is slechts een van de vele alcoholen die bestaan. De synthesereactie bestaat uit de hydratatie van ethyleen, c2H4 of h2C = Ch2, waarbij een watermolecuul wordt toegevoegd aan zijn dubbele binding.
Zwavelzuur
Zwavelzuur heeft verschillende efficiënte synthetische routes. De eenvoudigste bestaat echter uit verschillende stappen:
Kan u van dienst zijn: carboxymethylcelluloseS (s) +o2(g) → Dus2(G)
2 Dus2(g)+of2(g) ⇌ 2 Dus3(G)
SW3(g)+H2Of (l) → h2SW4(G)
H2SW4(g) → h2SW4(L)
Zwavel brandt met overtollige zuurstof om eerst in So te transformeren2, En dan in So3. Dan de So3 is gehydrateerd om H -dampen te produceren2SW4, die uiteindelijk in h condenseren2SW4 vloeistof. Deze synthese is zo belangrijk, dat het op zichzelf aangeeft hoe sterk.
Methanol
CO (G) + 2 H2(g) → ch3Oh (L)
De gassen co en h2 React en condenseren op metalen katalysatoren om methanol te geven, de eenvoudigste alcohol van allemaal.
Magnesiumsulfaat
Het kan optreden uit een zeer eenvoudige reactie die bestaat uit magnesium en zwavelzuur. Het is heel moeilijk om het in de natuur te vinden zonder water.
Mg + H2SO4 → H2 + MGSO4
Kooldioxide
Het gebeurt natuurlijk in verschillende processen, wanneer koolstofdioxide wordt geproduceerd met koolstofdioxidemolecuul.
Het is aanwezig in natuurlijke processen zoals ademhaling, als een reagens in fotosynthese en komt gemakkelijk voor bij verbrandingsreacties.
C +O2 → CO2
Zoutzuur
Zoutzuur wordt veel gebruikt als een goedkoop zuur en als een reactief middel voor de synthese van andere verbindingen.
Cl2+H2 → 2HCl
Calciumcarbonaat
Het is algemeen bekend als een zeer overvloedig middel in de natuur, voornamelijk in rotsen, mineralen en schelpen in de zee. De reactie ervan is gebaseerd op de interactie van calciumoxide met koolstofdioxide.
CAO +CO2 → CACO3
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Metler Toledo. (S.F.)). Synthesiereacties. Hersteld van: MT.com
- Helmestine, Anne Marie, pH.D. (27 augustus 2020). Synthesereactiebeschrijving plus examens. Opgehaald van ThoughtCo.com
- Wikipedia. (2020). Chemische synthese. Opgehaald uit: in.Wikipedia.borg
- Danielle Reid. (2020). Synthesereactie: definitie, formule en voorbeeld. Studie. Hersteld van: studie.com
- « Delen van het verhaal en de kenmerken ervan (met voorbeelden)
- De 10 belangrijkste Argentijnse helden »

