Radicalen verhuren hoe ze zich vormen, nomenclatuur, voorbeelden

- 1814
- 326
- James Dach
De Radicalen huur Ze zijn een reeks onstabiele moleculen die afkomstig zijn van het verlies van hydrogenen van een alkaan. Ze worden gekenmerkt door een verdwenen elektron te hebben, dus reageren ze snel om het octet van Valencia van het atoom te voltooien waar het zich bevindt.
Deze radicalen worden gesymboliseerd met de letter R, net als de huurgroepen, maar met het verschil dat een punt wordt toegevoegd, r ·. Dit punt geeft de aanwezigheid van een elektron aan dat is verdwenen. Overweeg bijvoorbeeld methaangas, cho4. Deze alkaan, die een van zijn hydrogenen verliest, zal worden omgezet in de radicale methyl, cho3· (Afbeelding hieronder).
 Algemene formule van een radicaal alkyl en de radicale methyl. Bron: Gabriel Bolívar via Molview.
Algemene formule van een radicaal alkyl en de radicale methyl. Bron: Gabriel Bolívar via Molview. Als je een beetje wilt verdiepen over de radicale structuur CH3·, Het zal zien dat het verdwenen elektron onder een hoek loodrecht op de C-H-banden staat; dat wil zeggen, het bevindt zich in een orbitaal P zuiver. Daarom Cho3· Neem een SP -hybridisatie aan2, evenals, in het algemeen, met andere radicalen alkyl.
Deze radicalen zijn de hoeksteen van de kettingreacties waar de alkanen deelnemen, zoals het geval is van hun halogenaties: chlorering, bromering, enz. Er zijn 1e, 2e en 3e radicalen, evenals vinyl en alilisch, elk met hun respectieve stabiliteit en gemak van training.
[TOC]
Hoe worden radicalen alkyl gevormd?
De "eenvoudigere" reactie waarvoor radicalen worden gevormd, is de halogenering van de alkanen. Om te vormen moet de kettingreactie worden gegeven, die alleen optreedt bij hoge temperaturen (meer dan 250 ºC), of onder de incidentie van ultraviolet licht bij kamertemperatuur.
Kan u van dienst zijn: natriumsulfiet (Na2SO3)Overweeg de chlorering van methaan onder een van de hierboven genoemde voorwaarden:
Klet2 → 2cl ·
De verstrekte energie is voldoende om de CL-CL-link van het chloormolecuul te verbreken, waardoor een homolitische breuk plaatsvindt; dat wil zeggen, elk chlooratoom blijft bij een van de linkelektronen. Daarom worden twee radicalen gevormd.
Vervolgens valt een radicale Cl · een methaanmolecuul aan:
Cl · + ch4 → HCl + CH3·
En de radicale methyl verschijnt. Dit Ch3· Het is vrij onstabiel, dus het zal onmiddellijk reageren om een extra elektron te winnen waarmee het zijn enige elektron zal verschijnen:
Ch3· + Cl2 → ch3Cl + CL ·
De gevormde zal reageren met een ander methaanmolecuul en de cyclus zal steeds opnieuw worden herhaald. Terwijl het methaan oploopt, zullen de volgende reacties optreden die de kettingreactie zullen beëindigen:
CL · + · CL → Cl2
Ch3· + · Cho3 → ch3Ch3
Ch3· + · Cl → CH3Klet
Relatieve stabiliteit
Ch3
Methaan is niet de enige alkaan die "geradicaliseerd" is door chlorering. Het gebeurt ook hetzelfde met ethaan, propaan, butane en andere isomeren. Wat echter varieert, is de noodzakelijke energie die moet worden verstrekt zodat de radicalen cl · dehydrogeren een molecuul alkaan. In het geval van de methylradicaal is het zeer onstabiel en daarom moeilijk te vormen.
Dus de radicale cho3Ch2· Het is stabieler en gemakkelijker te vormen dan cho3·. Omdat? Omdat de radicale ch3Ch2· Het is primair, 1e, wat betekent dat het verdwenen elektron zich op een koolstofatoom bevindt dat is gekoppeld aan een andere koolstof. Ondertussen, Cho3Zodra het is gekoppeld aan waterstofatomen.
Kan u van dienst zijn: fluoride: geschiedenis, eigenschappen, structuur, verkrijgen, risico's, gebruikWaar gaat dit over? Het verdwenen elektron onthouden de vorige weergave en bevindt zich in een orbitaal P, loodrecht op de andere links. In ch3· Doneren waterstofatomen nauwelijks elektronische dichtheid aan het koolstofatoom, in een poging om het ontbreken van een ander elektron te compenseren.
1e
In ch3Ch2· Aan de andere kant is koolstof met het verdwenen elektron gekoppeld aan twee hydrogenen en een methylgroep. Bijgevolg ontvangt deze koolstof een grotere elektronische dichtheid, die helpt het elektron te stabiliseren dat een beetje is verdwenen. Dezelfde verklaring is geldig voor andere 1e Alkynd -radicalen.
2e
In een radicaal secundair of 2e alquil, zoals de isopropil radicaal, (CH3))2C. Daarom is het stabieler dan 1e en methylradicalen.
3e
We hebben ook tertiaire of 3e alkynd radicalen, zoals de ter-butylradicaal3))3C ·. Deze zijn stabieler dan de 1e en 2e. Nu zijn er drie koolzuurhoudende groepen anders dan het waterstofatoom dat het verdwenen elektron stabiliseert.
Allylisch en vinyl
Het is ook de moeite waard om de allylische radicalen te vermelden, cho2= Ch-ch2· En vinyl, cho2= Ch ·.
Alilic is de meest stal van allemaal. Dit komt omdat het verdwenen elektron zelfs in staat is om naar het koolstofatoom van het andere uiteinde te gaan. De Vínilico is daarentegen de meest onstabiele van allemaal, sinds de Cho -groep2=, meer zuur, trekt elektronische dichtheid naar zichzelf in plaats van het aan koolstof te doneren met het verdwenen elektron.
Kan u van dienst zijn: loodhydroxide: structuur, eigenschappen, gebruik, risico'sSamenvattend zijn de relatieve stabiliteit van de alkynd -radicalen, van de hoogste tot laagste,:
Alilo> 3e> 2e> 1e> Vinyl
Nomenclatuur
De nomenclatuur van de radicalen alkyl is hetzelfde als voor de remedie. Dus cho3Ch2· Wordt ethylradicaal genoemd; en de radicale ch3Ch2Ch2Ch3, N-butyl.
Hoofdradicalen huur
De belangrijkste alkylradicalen vallen samen met alkylgroepen: zij zijn die met minder dan zes koolstofatomen. Daarom zijn de radicalen afgeleid van methaan, ethaan, propaan, butaan en pentano, zijn de meest voorkomende. Evenzo maken het radicale vinyl en Alilicos deel uit van deze lijst.
Andere alkynd -radicalen die minder vaak worden gevonden, zijn die die afkomstig zijn van cycloalcanos, zoals cyclobutaan, cyclobutaan of cyclopentano.
In de volgende afbeelding worden verschillende van deze radicalen weergegeven met toegewezen letters:
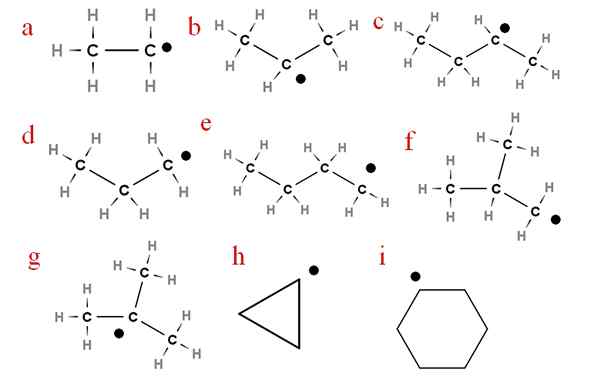 Negen van de belangrijkste alchery -radicalen. Bron: Gabriel Bolívar.
Negen van de belangrijkste alchery -radicalen. Bron: Gabriel Bolívar. Beginnend met de letter 'a', hebben we:
-A, ethylradicaal
-B, isopropylradicaal
-C, Secbutyl Radical
-D, radicaal propyl
-E, radicaal N-butyl
-F, isobutil radicaal
-G, ter-butyl radicaal
-H, radicale cycropilus
-Ik, radicaal cyclohexil
Elk van deze radicalen kan al dan niet hun hydrogenen laten vervangen door andere groepen, dus ze zijn even gevarieerd als de alkanen en hun structurele isomeren.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e editie.)). Wiley Plus.
- Wikipedia. (2020). Alkyl. Opgehaald uit: in.Wikipedia.borg
- Chemistry Libhethexts. (5 juni 2019). Structuur van alkylradicalen: hyperconjugatie. Hersteld van: chem.Librhetxts.borg
- « Cross Referenties Concept, functies, voorbeelden
- Aquatische dierenkenmerken, ademhaling, types, voorbeelden »

