Wat zijn de anode en kathode?

- 3975
- 908
- Cecil Graham
Hij anode en kathode Het zijn de soorten elektroden die worden gevonden in elektrochemische cellen. Dit zijn apparaten die elektriciteit kunnen produceren door een chemische reactie. De meest gebruikte elektrochemische cellen zijn batterijen.
Er zijn twee soorten elektrochemische cellen, elektrolytische cellen en galvanische of voltaïsche cellen. In elektrolytische cellen gebeurt de chemische reactie geproduceerd door energie niet spontaan, maar de elektrische stroom wordt omgezet in een chemische oxidatiereactie.

De galvanische cel bestaat uit twee semi -lodgs. Deze zijn verbonden door twee elementen, een metalen bestuurder en een zoutoplossingbrug.
De elektrische geleider, zoals aangegeven door zijn naam, leidt elektriciteit omdat hij zeer weinig weerstand heeft tegen de beweging van de elektrische lading. De beste stuurprogramma's zijn meestal metalen.
De zoutoplossingbrug is een buis die de twee semi -nllads verbindt, met behoud van hun elektrische contact, en zonder de componenten van elke cel te laten voegen.Elke semi -media van de galvanische cel bevat een elektrode en een elektrolyt.
Wanneer de chemische reactie optreedt, verliest een van de semi -nllads elektronen aan zijn elektrode, door het oxidatieproces; Terwijl de andere elektronen wint voor elektrode, via het reductieproces.
Oxidatieprocessen worden geproduceerd in de anode en de reductieprocessen in de kathode
[TOC]
Anode
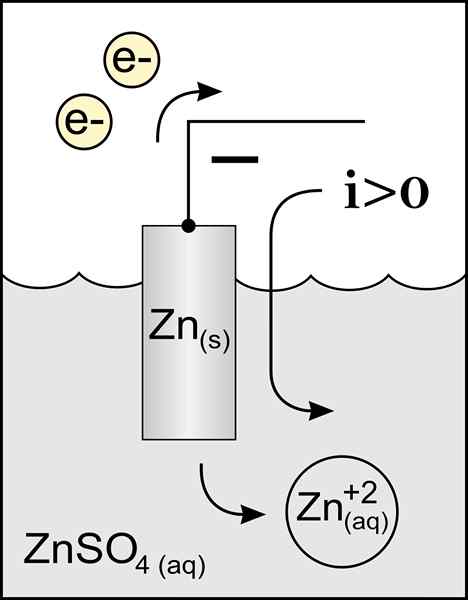 Diagram van een zinkanode in een voltaische cel. Bron: origineel werk: Bestand: zinkanode 2.PNG door gebruiker: Micheljullian (Talk) Derivatief Werk: KES47/CC BY-S (http: // CreativeCommons.Org/licenties/by-sa/3.0/)
Diagram van een zinkanode in een voltaische cel. Bron: origineel werk: Bestand: zinkanode 2.PNG door gebruiker: Micheljullian (Talk) Derivatief Werk: KES47/CC BY-S (http: // CreativeCommons.Org/licenties/by-sa/3.0/) De naam van de anode komt van de Griekse ανά (aná): Up, en οδός (odós): pad. Faraday was degene die deze term in de negentiende eeuw bedacht.
De beste bepalende anode is de elektrode die elektronen verliest in een oxidatiereactie. Normaal gesproken is het gekoppeld aan de positieve pool van de doorvoer van de elektrische stroom, maar het is niet altijd het geval.
Kan u van dienst zijn: gewaardeerde oplossingenHoewel in de batterijen de anode de positieve pool is, is het in de LED -lichten het tegenovergestelde, de anode is de negatieve pool.
Normaal gesproken wordt het gevoel van elektrische stroom gedefinieerd en waardeert het als een gevoel van vrije belastingen, maar als de bestuurder niet metaalachtig is, worden de positieve ladingen die worden geproduceerd overgedragen aan de externe driver.
Deze beweging impliceert dat we positieve en negatieve ladingen hebben die in tegengestelde zintuigen bewegen, dus er wordt gezegd dat de richting van de stroom de route is van de positieve ladingen van de kationen die zich in de anode bevinden in de richting van de negatieve belasting van de anodes van de Anodes die in de kathode worden gevonden.
In galvanische cellen, met een metalen geleider, volgt de stroom die in de reactie wordt gegenereerd, het pad van de positieve pool naar het negatieve.
Maar in elektrolytische cellen, geen metalen geleider, maar een elektrolyt, ionen met positieve en negatieve belasting die in tegengestelde zintuigen kunnen worden gevonden.
Thermoionische anodes ontvangen de meeste elektronen die uit de kathode komen, verwarmen de anode en moeten een manier vinden om te verdwijnen. Deze warmte wordt gegenereerd in de spanning die optreedt tussen elektronen.
Speciale anodes
Er is een soort speciale anodes, zoals die binnen x -reeks. In deze buizen genereert de energie die wordt geproduceerd door elektronen, naast het produceren van x -reeks, grote energie die de anode verwarmt.
Deze warmte komt voor op de verschillende spanning tussen beide elektroden en die druk uitoefent op elektronen. Wanneer elektronen in de elektrische stroom bewegen, raken ze de anode door hun warmte te verzenden.
Kan u van dienst zijn: Henderson-Haselbalch Vergelijking: uitleg, voorbeelden, oefeningKathode
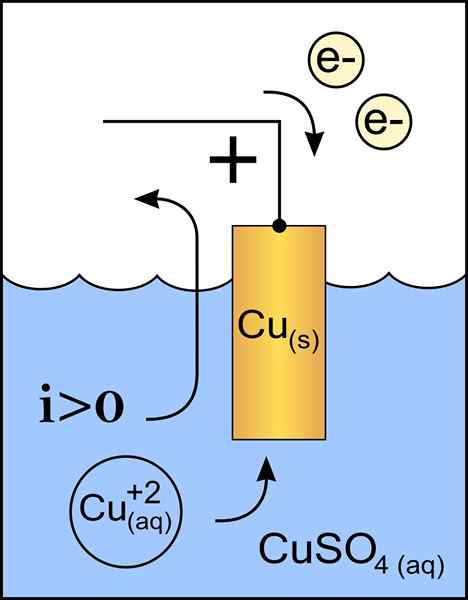 Koperen kathodediagram in een voltaische cel. Bron: origineel werk: Bestand: zinkanode 2.PNG door gebruiker: Micheljullian (Talk) Derivatief Werk: KES47/CC BY-S (http: // CreativeCommons.Org/licenties/by-sa/3.0/)
Koperen kathodediagram in een voltaische cel. Bron: origineel werk: Bestand: zinkanode 2.PNG door gebruiker: Micheljullian (Talk) Derivatief Werk: KES47/CC BY-S (http: // CreativeCommons.Org/licenties/by-sa/3.0/) De kathode is de elektrode met negatieve belasting, die in de chemische reactie een reductiereactie lijdt, waarbij de oxidatiestatus ervan wordt verminderd wanneer het elektronen ontvangt.
Net als bij de anode was het Faraday die de term kathode voorstelde die afkomstig is van de Griekse κατά [catá]: 'omlaag' en ὁδός [odós]: 'Road'. Aan deze elektrode werd de negatieve belasting in de loop van de tijd toegeschreven.
Deze aanpak was onjuist, omdat, afhankelijk van het apparaat waarin het zich bevindt, het een lading of een andere heeft.
Deze relatie met de negatieve pool, zoals bij de anode, komt voort uit de veronderstelling dat de stroom van de positieve pool naar het negatieve stroomt. Dit ontstaat in een galvanische cel.
Binnen de elektrolytische cellen kan de overdrachtsmiddelen van energie, omdat het niet in een metaal is maar in een elektrolyt, naast negatieve en positieve ionen naast elkaar bestaan die in tegengestelde zintuigen bewegen. Maar in overeenstemming wordt gezegd dat de huidige van de anode naar de kathode gaat.
Speciale kathoden
Een type specifieke kathoden zijn thermionische kathoden. Hierin stoot de kathode elektronen uit vanwege het effect van warmte.
In thermionische kleppen kan de kathode zichzelf verwarmen door een verwarmingsstroom te circuleren in een gloeidraad met deze gekoppeld.
Evenwichtsreactie
Als we een galvanische cel nemen, die de meest voorkomende elektrochemische cel is, kunnen we de gegenereerde evenwichtsreactie formuleren.
Elke semi -media die de galvanische cel vormt, heeft een karakteristieke spanning die bekend staat als reductiepotentieel. Binnen elke semi -media is er een oxidatiereactie tussen de verschillende ionen.
Kan u van dienst zijn: absorptiespectrumWanneer deze reactie een evenwicht bereikt, kan de cel niet meer spanning bieden. Op dit moment zal de oxidatie die plaatsvindt in de semi -media van dat moment een positieve waarde hebben, hoe dichterbij de balans is. Het potentieel van de reactie zal groter zijn, hoe meer evenwicht het is bereikt.
Wanneer de anode in evenwicht is, begint deze elektronen te verliezen die door de bestuurder naar de kathode gaan.
In de kathode vindt de reductiereactie plaats, hoe verder de meest potentiële balans de reactie zal hebben bij het produceren en nemen van de elektronen die uit de anode komen.
Referenties
- Huheey, James en., et al.Anorganische chemie: principes van structuur en reactiviteit. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, een.Chemie: principes en eigenschappen. New York, VS: McGraw-Hill, 1966.
- Brady, James en.Algemene chemie: principes en structuur. Wiley, 1990.
- Petrucci, ralph h., et al.Algemene scheikunde. Inter -American Educational Fund, 1977.
- Masterton, William L.; Hurley, Cecile N.Chemie: principes en reacties. Cengage Learning, 2015.
- Charlot, Gaston; Tremillon, Bernard; Badoz-Lambling, J. Elektrochemische reacties. Toray-Masson, 1969.

