Eiwitten G structuur, typen en functies
- 1861
- 286
- Pete Heaney V
De G of Guanine nucleotide bindende eiwitten, Het zijn eiwitten geassocieerd met het plasmamembraan dat behoort tot een familie van "koppelingen" van signalen die belangrijke functies hebben in veel signaaltransductieprocessen in eukaryotische organismen.
In de literatuur worden G -eiwitten beschreven als binaire moleculaire schakelaars, omdat hun biologische activiteit wordt bepaald door de veranderingen in hun structuur gegeven door de nucleotidesoorten waaraan ze kunnen deelnemen: guanosine -nucleotiden (difosfaat (BBP) en typosfaat (GTP)).
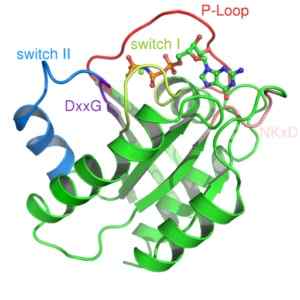
 Structuur van het RAS -eiwit, een monomeer G -eiwit (bron: Mark 'Absturz' [public domein] via Wikimedia Commons)
Structuur van het RAS -eiwit, een monomeer G -eiwit (bron: Mark 'Absturz' [public domein] via Wikimedia Commons) Ze worden over het algemeen geactiveerd door receptoren van een familie van eiwitten die bekend staan als GPCR -gekoppelde receptoren (GPCR, Engels "G-eiwit-gekoppelde ontvangers "), die een extern initiële signaal ontvangen en het conformationele veranderingen maken die activering veroorzaken, die zich vervolgens vertaalt in de activering van een ander effector -eiwit.
Sommige auteurs zijn van mening dat de coderende genen voor deze familie van eiwitten zijn geëvolueerd in duplicatie en divergentie van een voorouderlijk gemeenschappelijk gen, wiens product meer en meer werd verfijnd en gespecialiseerd.
Een van de grote verscheidenheid aan cellulaire functies die deze eiwitten hebben, zijn de translocatie van macromoleculen tijdens eiwitsynthese, transductie van hormonale signalen en sensorische stimuli, evenals de regulatie van proliferatie en celdifferentiatie.
Twee klassen zijn beschreven uit dit type eiwit: kleine G -eiwitten en heterotrofimere G -eiwitten. De eerste drie -dimensionale structuur van een G -eiwit werd meer dan een decennium verkregen van een klein G -eiwit dat bekend staat als RAS.
[TOC]
Structuur
Structureel worden twee soorten G -eiwitten herkend: kleine G -eiwitten en heterotrimische G -eiwitten, veel complexer.
Kleine G-eiwitten worden gevormd door een enkel polypeptide van ongeveer 200 aminoaceous afval en ongeveer 20-40 kDa, en in zijn structuur is er een geconserveerd katalytisch domein (het domein G) bestaande uit vijf α-propellers, zes β-geplooide laken lussen.
Heterotrofimere G -eiwitten zijn daarentegen uitgebreide membraaneiwitten die zijn samengesteld uit drie polypeptideketens, bekend als de a, β- en y -subeenheden.
-De a -subeenheid weegt tussen 40 en 52 kDa, heeft een guanine -nucleotide -bindingsgebied en heeft GTPASA -activiteit om verbanden tussen GTP -fosfaatgroepen te hydrolyseren.
De a -subeenheden van verschillende G -eiwitten delen enkele structurele domeinen zoals GTP -unie en hydrolyse, maar zijn zeer verschillend in de receptorbindingsplaatsen en effector -eiwitten.
Kan u van dienst zijn: mitotische spindel-De β -subeenheid heeft een iets lager molecuulgewicht (tussen 35 en 36 kDa).
-De γ -subeenheid is daarentegen veel kleiner en heeft een geschat molecuulgewicht van 8 kDa.
Alle heterotrofimere G. Deze twee domeinen zijn zo sterk geassocieerd dat ze worden beschouwd als een enkele functionele eenheid.
Jongens
Zoals eerder vermeld, zijn er twee soorten G -eiwitten: kleine en heterotriméricas.
Kleine G -eiwitten hebben functies in celgroei, eiwitsecretie en interactie van intracellulaire blaasjes. Van hun kant zijn heterotrofimere G -eiwitten geassocieerd met signaaltransductie van oppervlakteceptoren, en werken ook als schakelaars die afwisselen tussen twee toestanden, afhankelijk van het bijbehorende nucleotide.
Kleine G -eiwitten
Deze eiwitten worden ook kleine GTPASA's, kleine GTP -junctie -eiwitten of RAS -eiwit -superfamilie genoemd en vormen een onafhankelijke superfamilie binnen de grote klasse van hydrolase -GTP met regulerende functies.
Deze eiwitten zijn erg divers en besturen meerdere cellenprocessen. Ze worden gekenmerkt door een geconserveerd domein van binding aan GTP, het domein "G". De vereniging van dit nucleotide -fosfaat veroorzaakt kleine conformationele veranderingen in zijn katalytische domein in GD -eiwitten.
De activiteit ervan is nauw gerelateerd aan GTPASA's die eiwitten activeren (GAP, Engels "GTPase Activerende eiwit ") en met guanina nucleotide -uitwisselingsfactoren (GEF, Engels "Guanine nucleotide -uitwisselingsfactor ”).
In eukaryoten zijn vijf klassen of families van kleine G -eiwitten beschreven:
-Ras
-Rho
-Razen
-SAR1/ARF
-Ran
Ras- en Rho -eiwitten regelen genetische expressie en Rho -eiwitten moduleren ook de reorganisatie van het cytoskelet. Rab- en SAR1/ARF -groepseiwitten hebben invloed op vesiculair transport en eiwitten reguleren nucleair transport en celcyclus.
Heterotrofimere G -eiwitten
Dit type eiwit verdient ook een associatie met twee andere eiwitfactoren, zodat de signaalroute van buiten naar het cellulaire interieur uit drie elementen in de volgende volgorde bestaat:
- De gekoppelde receptoren Een eiwitten g
- De G
- De Eiwitten of de Effectieve kanalen
Er is een grote diversiteit aan heterotrofimeer G -eiwit en dit is gerelateerd aan de grote diversiteit van α -subeenheden die in de natuur bestaan, waarin slechts 20% van de aminozuursequentie wordt bewaard.
Gewoonlijk worden heterotrofimere G -eiwitten geïdentificeerd dankzij de diversiteit van de a -subeenheid, voornamelijk gebaseerd op hun functionele en sequentie -overeenkomsten.
De a -subeenheden vormen vier families (de GS -familie, de GI/O -familie, de GQ -familie en de G12 -familie). Elk gezin bestaat uit een ander "isotype" dat samen meer dan 15 verschillende manieren van α -subeenheden toevoegt.
Familie GS
Deze familie bevat vertegenwoordigers die ook deelnemen aan de positieve regulatie van cyclase adenylaat -eiwitten en wordt tot expressie gebracht in de meeste celtypen. Het bestaat uit twee leden: GS en Golf.
Het subscript "S " Het verwijst naar stimulatie (uit het Engels "Stimulatie ") en het subscript "OLF " Het verwijst naar "ruiken" (uit het Engels "Olfactie")). Golfeiwitten worden vooral uitgedrukt in de sensorische neuronen die verantwoordelijk zijn voor de geur.
Familie Gio
Dit is de grootste en diverse familie. Ze worden uitgedrukt in veel celtypen en bemiddelen de ontvangende afhankelijke remming van verschillende soorten adenylciclasses (het subscript "Yo " verwijst naar remming).
Eiwitten met groep α -subeenheden worden vooral tot expressie gebracht in cellen van het centrale zenuwstelsel en hebben twee varianten: A en B.
Familie GQ
Eiwitten met deze familie van a -subeenheid zijn verantwoordelijk voor de regulatie van fosfolipase C. Deze familie bestaat uit vier leden wier α -subeenheden worden uitgedrukt door verschillende genen. Ze zijn overvloedig in levercellen, in niercellen en longen.
Familie G12
Deze familie wordt alomtegenwoordig uitgedrukt in organismen en het is niet met zekerheid bekend wat de cellulaire processen precies gereguleerd door eiwitten met deze subeenheden zijn.
Β- en γ -subeenheden
Hoewel de diversiteit van alfa -structuren beslissend is voor de identificatie van heterotimere eiwitten, is er ook veel diversiteit met betrekking tot de andere twee subeenheden: bèta en gamma.
Functie
G -eiwitten nemen deel aan de "channeling" van de signalen van de receptoren in het plasmamembraan naar de effectorkanalen of enzymen.
Het meest voorkomende voorbeeld van de functie van dit type eiwit is in de regulatie van de enzym adenylaat cyclasa, enzym dat verantwoordelijk is voor de synthese van adenosine 3 ', 5'-monofosfaat of eenvoudig cyclische versterker, een molecuul dat belangrijke functies heeft als tweede messenger In veel bekende celprocessen:
Kan u van dienst zijn: caliciforme cellen-Selectieve eiwitfosforylering met specifieke functies
-Genetische transcriptie
-Reorganisatie van het cytoskelet
-Afscheiding
-Membraandepolarisatie
Ze nemen ook indirect deel aan de regulatie van de inositolen die waterval signaleren (fosfatidylinitol en hun gefosforyleerde derivaten), die verantwoordelijk zijn voor controle van calciumafhankelijke processen zoals chemiotaxis en de secretie van oplosbare factoren.
Veel ionische kanalen en transporteiwitten worden rechtstreeks gecontroleerd door eiwiteiwitten G. Evenzo zijn deze eiwitten betrokken bij veel sensorische processen zoals visie, geur, onder anderen.
Hoe werken ze?
De modus van interactie van een G -eiwit met effector -eiwitten is typerend voor elke klasse of familie van eiwitten.
Voor G-Grebranale receptor G-eiwitten (heterotrofimere G-eiwitten), veroorzaakt de vereniging van een guanine-nucleotide zoals GDP of guanosín difosfaat om subeenheid α de associatie van de drie subeenheden te vormen, die een complex vormt als Gαβγ of GDP, dat is gekoppeld, dat is verbonden. naar het membraan.
Als het GDP-molecuul vervolgens wordt uitgewisseld door een GTP-molecuul, dissocieert de α-subeenheid die is bevestigd aan de GTP van de β- en γ-subeenheden en vormt een afzonderlijk complex dat bekend staat als Ga-GTP, dat de activiteit van zijn enzymen of diana-betaalor kan veranderen eiwitten.
De hydrolytische activiteit van deze subeenheid stelt u in staat om de activering te voltooien en de GTP uit te wisselen voor een nieuw bbp, naar de inactieve conformatie.
Bij afwezigheid van de geëxciteerde receptoren die worden geassocieerd met het BBP -beursproces, is het erg traag, wat betekent dat heterotrofimere G -eiwitten alleen het bbp voor GTP uitwisselen voor een fysiologisch belangrijke snelheid wanneer ze zijn verbonden met hun opgewonden receptoren.
Referenties
- Gilman, g. (1987). G-eiwitten: Transduers of Receiver Geneed Signals. Jaarlijkse beoordelingen in biochemie, 56, 615-649.
- Milligan, g., & Kostenis, en. (2006). Heterotrimic G-eiwitten: een korte geschiedenis. British Journal of Pharmacology, 147, 546-555.
- Offermanns, s. (2003). G-eiwitten als transduers in transmembraansignalering. Vooruitgang in biofysica en moleculaire biologie, 83, 101-130.
- Simon, m., Strathmann, m. P., & Gautam, n. (1991). Diversiteit van G -eiwitten in signaaltransductie. Wetenschap, 252, 802-808.
- Syrovatkina, V., Vrolijk, k. OF., Dey, r., & Huang, x. (2016). Regulatie, signalering en fysiologische functies van G-eiwitten. Journal of Molecular Biology, 428(19), 3850-3868.
- « Crotalus triseriatus kenmerken, habitat, reproductie
- Thunder -kenmerken, habitat, taxonomie, eigenschappen »

