Vezelige eiwitten
- 2259
- 696
- Dr. Rickey Hudson
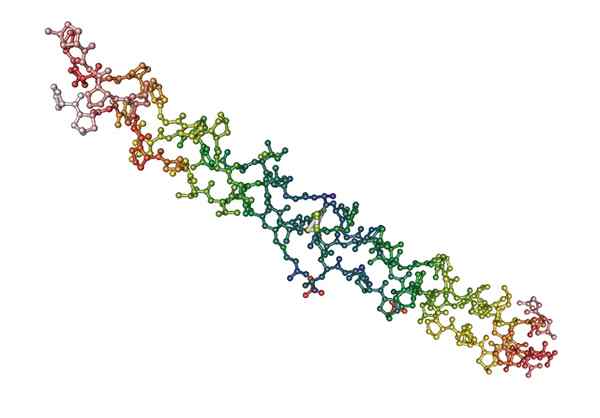
 Moleculaire structuur van collageen, een vezelachtig eiwit van dierlijke oorsprong (bron: nevit dilmen [cc by-s (http: // creativeCommons.Org/licenties/by-sa/3.0/)] via Wikimedia Commons)
Moleculaire structuur van collageen, een vezelachtig eiwit van dierlijke oorsprong (bron: nevit dilmen [cc by-s (http: // creativeCommons.Org/licenties/by-sa/3.0/)] via Wikimedia Commons) Wat zijn vezelige eiwitten?
De vezelige eiwitten, Ook bekend als scleroproteïnen, ze zijn een klasse van eiwitten die een belangrijk onderdeel zijn van de structurele componenten van elke levende cel. Collageen, elastine, keratine of fibroine zijn voorbeelden van dit type eiwit.
Ze vervullen zeer diverse en complexe functies. De belangrijkste zijn die van bescherming (zoals de doornen van een stekelvarken) of ondersteuning (zoals degene die spinnen de stof levert die ze weven en die hen opgehangen houdt).
Vezelachtige eiwitten zijn samengesteld uit volledig uitgebreide polypeptideketens, die georganiseerd zijn en een soort "vezel" of "touw" van grote weerstand vormen. Deze eiwitten zijn mechanisch zeer sterk en zijn onoplosbaar in water.
Voor het grootste deel zijn de componenten van vezelachtige eiwitten opeenvolgend herhaalde aminozuurpolymeren.
De mensheid heeft het geprobeerd.
Structuur
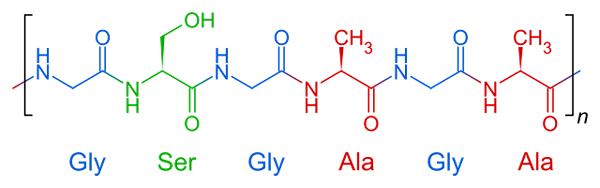 Repetitieve structuur van zijden fibroine, een vezelachtig eiwit
Repetitieve structuur van zijden fibroine, een vezelachtig eiwit Vezelachtige eiwitten hebben een relatief eenvoudige samenstelling in hun structuur. Ze worden over het algemeen gevormd door drie of vier verenigde aminozuren tussen.
Dat wil zeggen, als een eiwit bestaat uit aminozuren zoals lysine, arginine en tryptofaan, het volgende aminozuur dat zich zal aansluiten.
Er zijn vezelachtige eiwitten met aminozuurmotieven op afstand van twee of drie aminozuren die verschillen van de repetitieve motieven van hun sequenties en in andere eiwitten kan de aminozuursequentie zeer variabel zijn, van 10 of 15 verschillende aminozuren.
Kan u van dienst zijn: ovuliparosDe structuren van veel van de vezelachtige eiwitten zijn gekenmerkt met X -Ray Crystallography Techniques en door nucleaire magnetische resonantiemethoden. Dankzij dit zijn eiwit met vezelvormige, buisvormige, laminaire, spiraal-, "trechter", enz. Gedetailleerd, enz.
Elk polypeptide van herhaalde motieven uniek vormt een gloeidraad en elke gloeidraad is een eenheid van de honderden eenheden die de ultrastructuur vormen van een "vezelachtig eiwit". Over het algemeen is elke gloeidraad op een spiraalvormige manier beschikbaar ten opzichte van de anderen.
Functie
Vanwege het vezelnetwerk dat vezelachtige eiwitten vormt, bestaan hun belangrijkste functies uit het dienen als structurele ondersteuning, weerstand en beschermingsmateriaal voor de weefsels van de verschillende levende organismen.
Beschermingsstructuren bestaande uit vezelachtige eiwitten kunnen de vitale organen beschermen tegen gewervelde dieren tegen mechanische slagen, ongunstige klimatologische omstandigheden of roofzuchtige aanval.
Het niveau van specialisatie van vezelachtige eiwitten is uniek in het dierenrijk. Spider Web is bijvoorbeeld een essentiële ondersteuningsstof voor de manier van leven die spinnen dragen. Dit materiaal heeft unieke weerstand en flexibiliteit.

Zoveel dat momenteel veel synthetische materialen proberen de flexibiliteit en weerstand van Spider Web opnieuw te creëren, zelfs het gebruik van transgene organismen om dit materiaal te synthetiseren door biotechnologische hulpmiddelen. Er moet echter worden opgemerkt dat het verwachte succes nog niet is verkregen.
Een belangrijke eigenschap die vezelige eiwitten hebben, is dat ze het verband mogelijk maken tussen de verschillende weefsels van gewervelde dieren.
Het kan u van dienst zijn: OxidorReductasen: kenmerken, structuur, functies, voorbeeldenBovendien kunnen de veelzijdige eigenschappen van deze eiwitten levende organismen maken om materialen te creëren die weerstand en flexibiliteit combineren. Dit is in veel gevallen wat de essentiële componenten vormt voor de beweging van de spieren in gewervelde dieren.
Vezelachtige eiwitvoorbeelden
Collageen
Het is een eiwit van dierlijke oorsprong en is misschien een van de meest voorkomende in het lichaam van gewervelde dieren, omdat de meeste bindweefsels samenstellen. De collageen valt op vanwege zijn sterke, uitbreidbare, onoplosbare en chemisch inerte eigenschappen.
Componeert - meestal - op de huid, hoornvlies, tussenwervelschijven, pezen en bloedvaten. Een collageenvezel bestaat uit een drievoudige parallelle propeller die bijna in zijn derde deel alleen de aminozuurglycine is.
Dit eiwit vormt structuren die bekend staan als "collageenmicrofibrillen", die bestaan uit de unie van verschillende drievoudige collageenpropellers met elkaar.
Elastine
 Elastine van de paarden van een paard. Bron: marta s. C. Godinho, chavaunne t. Thorpe, Steve E. Greenwald, & Hazel R. C. Scherm, CC BY-SA 4.0, via Wikimedia Commons
Elastine van de paarden van een paard. Bron: marta s. C. Godinho, chavaunne t. Thorpe, Steve E. Greenwald, & Hazel R. C. Scherm, CC BY-SA 4.0, via Wikimedia Commons Net als collageen is Elastin een eiwit dat deel uitmaakt van het bindweefsel. In tegenstelling tot de eerste biedt het echter elasticiteit voor weefsels, in plaats van weerstand.
Elastinevezels zijn samengesteld uit valine-, proline- en glycine -aminozuren. Deze aminozuren zijn zeer hydrofobe kenmerken en er is vastgesteld dat de elasticiteit van dit vezelachtige eiwit te wijten is aan elektrostatische interacties in zijn structuur.
Elastine is overvloedig aanwezig in weefsels die intensief worden onderworpen aan uitbreidings- en ontspanningscycli. In gewervelde dieren wordt het gevonden in slagaders, ligamenten, longen en huid.
Keratine
 Keratine. Bron: Maksim, CC BY-SA 3.0, via Wikimedia Commons
Keratine. Bron: Maksim, CC BY-SA 3.0, via Wikimedia Commons Keratine is een eiwit dat voornamelijk in de ectodermale laag van gewervelde dieren zit. Dit eiwit vormt belangrijke structuren als haar, nagels, doornen, veren, hoorns, onder andere.
Het kan je van dienst zijn: flora en fauna van het tropische bosKeratine kan worden samengesteld uit a-queratine of β-cheratine. Α-queratine is veel rigide dan β-cheatine. Dit komt omdat keratine-a bestaat uit α-propellers, die rijk zijn aan het cysteïne-aminozuur, dat het vermogen heeft om disulfidebruggen te vormen met andere gelijke aminozuren.
In β-dat daarentegen is het samengesteld in een groter deel van polaire en apolaire aminozuren, die waterstofbruggen kunnen vormen en zich kunnen organiseren in gevouwen β-platen. Dit betekent dat de structuur minder resistent is.
Fibroin
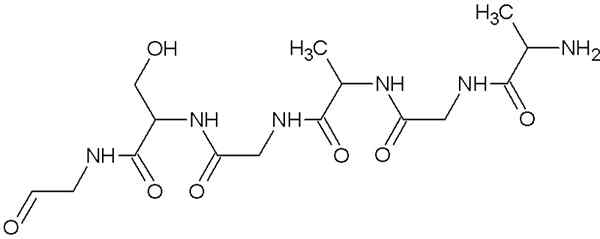 Moleculaire structuur van fibroine
Moleculaire structuur van fibroine Dit is het eiwit dat Spider Web en strengen samenstelt die door zijden wormen worden geproduceerd. Deze draden zijn meestal samengesteld uit glycine-, serine- en alanine -aminozuren.
De structuren van deze eiwitten zijn β -platen georganiseerde antiparallela tegen de oriëntatie van de gloeidraad. Dit kenmerk geeft het weerstand, flexibiliteit en weinig districtscapaciteit.
De fibroine is niet erg oplosbaar in water en is zijn grote flexibiliteit te danken aan de grote stijfheid dat de vereniging van aminozuren in zijn primaire structuur en de Vander Waals -bruggen, die worden gevormd tussen de secundaire groepen van de aminozuren.

