Kaliumnitriet (KNO2) structuur, eigenschappen en gebruik

- 3632
- 884
- James Dach
Hij Kaliumnitriet Het is een anorganisch zout waarvan de chemische formule is2, die chemisch en farmacologisch gerelateerd is aan kaliumnitraat3. Zijn fysieke uiterlijk bestaat uit geelachtige witte kristallen, zeer hygroscopisch en daarom delicues; dat wil zeggen, ze lossen snel op in vochtige omgevingen.
De formule geeft aan dat het aandeel kionen+ en niet2- Het is 1: 1 en blijven verenigd door elektrostatische krachten of door ionische links. Pure natuurlijke bronnen zijn blijkbaar niet gevonden voor hun kristallen, hoewel niteranionen te vinden zijn in bodem, meststoffen, planten en dieren.
 Kalium nitale kristallen. Bron: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Kalium nitale kristallen. Bron: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] De bovenste afbeelding laat zien hoe de kristallen van Kno eruit zien2, Met uitgesproken gele tonen. Als deze kristallen in contact staan met de lucht, zullen ze vocht absorberen om een waterige oplossing te worden; oplossing die controverses heeft gegenereerd met betrekking tot of het gebruik ervan nuttig is of niet.
Aan de andere kant worden de kristallen, onder zeer kleine hoeveelheden (200 ppm), gebruikt om vlees te bezaaid en hun behoud te garanderen tegen bacteriële werking. Ook de kno2 Verbetert de kleur van vlees en wordt ze meer roodachtig; Het is echter onderhevig aan verschillende beperkingen om de toxische effecten van dit zout op het lichaam te voorkomen.
[TOC]
Kaliumnitrietstructuur
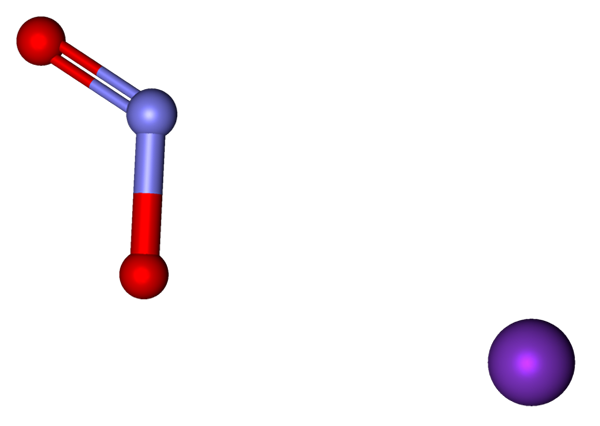 Ionen die deel uitmaken van de KNO2 vertegenwoordigd met een model van bollen en bars. Bron: Marinavladivok [CC0].
Ionen die deel uitmaken van de KNO2 vertegenwoordigd met een model van bollen en bars. Bron: Marinavladivok [CC0]. De ionen die aanwezig zijn in kaliumnitriet worden hierboven weergegeven. Het kation k+ komt overeen met de paarse bol, terwijl het anion dat niet doet2- Het wordt weergegeven door de blauwachtige en rode bollen.
Het anion nee2- Het wordt getoond met een dubbele binding en een eenvoudige [o = n-o]-; Maar in werkelijkheid zijn beide links hetzelfde als gevolg van de resonantie van de negatieve belasting ertussen.
De k -ionen+ en niet2- Ze trekken elkaar in de ruimte aan om een structureel patroon met de minste energie te organiseren; Dit is, waar de afstotingen tussen de gelijke belastingen minimaal zijn. En zo geloven de Kno -kristallen2, waarvan de eenheidscel vatbaar is voor temperatuurveranderingen, welke fase overgangen.
Kan u van dienst zijn: Stanislao CannizzaroBij lage temperaturen (minder dan 25 ° C) bijvoorbeeld de Kno -kristallen2 adopteer een monoklinisch systeem (fase I). Wanneer de temperatuur hoger is dan 25 ° C, treedt een rhombische monoklinische fase -overgang op (fase II). Ten slotte, boven 40 ° C2 Verandering om kubiek te zijn (fase III).
Ook de kno2 Kan andere kristallijne fasen (fasen IV, V en VI) vertonen onder hoge drukken. Hiermee, k -ionen+ en niet2- Ze bewegen en bestellen op verschillende manieren in hun pure kristallen.
Eigenschappen
Moleculaire massa
85,1038 g/mol.
Dikte
1,9150 g/ml.
Smeltpunt
440.02 ° C (maar begint af te breken van 350 ° C, waardoor giftige dampen worden uitgezonden).
Kookpunt
537 ° C (explosie).
Oplosbaarheid in water
312 g/ 100 g water bij 25 ° C.
Delicues
De oplosbaarheid in water is zodanig dat het hygroscopisch is; Zoveel, dat delicoscence vertoont, voldoende vocht absorbeert om op te lossen. Deze affiniteit voor water kan te wijten zijn aan de energiestabiliteit die kionen winnen+ Bij hydrateren, evenals een low crystalline netwerk enthalpie voor de kno -kristallen2.
Kristallen kunnen water absorberen zonder op te lossen om een hydraat te worden2· H2OF. In hydraat gaat het watermolecuul bij de ionen, wat de kristallijne structuur wijzigt.
Dit hydraat (of meerdere) kan onder -9 ° C worden gevormd; Bij een hogere temperatuur lost water op en hydrateert de ionen, waardoor het glas wordt vervormd.
Oplosbaarheid in andere oplosmiddelen
Enigszins oplosbaar in hete alcoholen, en zeer oplosbaar in ammoniak.
pH
6-9. Zijn waterige oplossingen zijn daarom alkalisch, omdat het anion dat niet doet2- Het kan hydrolyseren.
Nomenclatuur
Om te knopen2 Het kan ook op andere manieren worden genoemd. 'Kaliumnitriet' komt overeen met de naam voor dit zout volgens de stocknomenclatuur; 'Kalium nitrito', volgens de systematische nomenclatuur, waarin de enige valentie van kalium, +1 wordt benadrukt; en dioxonitraat (III) van kalium, volgens de systematische nomenclatuur.
Het kan u van dienst zijn: dibenzalacetona: eigenschappen, reactiemechanisme, gebruik, risico'sKalium 'dioxonitraat (III), benadrukt de valentie +3 van het stikstofatoom. Zelfs de naam die het meest wordt aanbevolen door de IUPAC voor de kno2, 'Kalium nitriet' blijft de meest comfortabele en het gemakkelijkst om te onthouden.
Het verkrijgen van
De meest directe manier om het te synthetiseren, maar met lagere prestaties, is door de thermische ontleding van kaliumnitraat of zoutpeter bij 400 ° C of meer:
2KNO3 => Kno2 + OF2
Een deel van de kno2 uiteindelijk ontleden door warmte, naast andere producten.
Een andere methode om het voor te bereiden of te synthetiseren met hogere prestaties is door de kno te verminderen3 In aanwezigheid van lood, koper of zink. De vergelijking voor deze reactie is als volgt:
Kno3 + Pb => kno2 + PBO
Kalium en loodnitraat zijn stoichiometrisch gemengd in een ijzeren pan, waar ze een half uur samenvloeien met constante agitatie en verwarming. Loodoxide (II) is geel en het resulterende deeg is heet en behandeld met kokend water. Dan filtert het hete mengsel.
De hot filter bubbels met koolstofdioxide gedurende vijf minuten, die loodcarbonaat, PBCO zal neerslaan3, onoplosbaar. Op deze manier is de hoofdrol af. Tikstofzuur verdund aan de filtering wordt toegevoegd totdat de pH neutraal is, het is toegestaan om af te koelen en uiteindelijk verdampt het water zodat de kristallen van kno worden gevormd2.
Toepassingen
Additief en reagens
Kaliumnitriet wordt gebruikt als een additief om rood vlees te genezen, hun smaak te behouden en meer tijdskleur tijdens opslag, terwijl bacteriële werking en bepaalde toxines, zoals botulinica vertraagt. Daarom vertoont het antibacteriële werking.
De kno2 Het oxideert niet, die reageert met myoglobine van het vlees en bijgevolg zijn natuurlijke rode kleur aanpassing. Wanneer het vlees wordt gekookt, verwerft het zijn karakteristieke sterke roze kleur.
Kan u van dienst zijn: 20 voorbeelden van chemische sublimatie en kenmerkenOnder omstandigheden zonder de kno te specificeren2 reageert met vleeseiwitten om aanleiding te geven tot nitrosamine, dat carcinogeen kan worden.
Aan de andere kant, de kno2 (hoewel bij voorkeur nano2) Het is een analytisch reagens dat kan worden gebruikt bij de synthese van azoïsche kleurstoffen (de reactie van stikstofzuur met aromatische amines) en in de aminozuuranalyse.
Tegengif
Hoewel het zijn negatieve effecten heeft, kno2 Het werkt als een tegengif bij vergiftigde patiënten met cyaniden en waterstofsulfide. Het mechanisme is om de centra van het geloof te oxideren2+ tot geloof3+ van de groepen die we hebben van de hemoglobines, die methemoglobine produceren, die vervolgens reageert met de CN -anionen- en HS-.
Artsen
In het maagsap van de maag doet het anion niet2- Het is gereduceerd tot niet, waarvan bekend is. In andere gebieden van het lichaam waar pH niet genoeg zuur is, zijn sommige enzymen, zoals geoxideerde xanthina, verantwoordelijk voor het verminderen van de niet - -2-.
Kno is gebruikt2 om kwalen en ziekten zoals borst angina en epilepsie te behandelen (met zeer negatieve bijwerkingen).
Referenties
- Wikipedia. (2019). Kaliumnitriet. Opgehaald uit: in.Wikipedia.borg
- Prebchem. (2016). Bereiding kaliumnitriet. Hersteld van: prapchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Anorganisch nitraat en nitriet en controle van bloeddruk, cardiovasculair onderzoek, volume 89, uitgave 3, 15 februari 2011, pagina's 492-498, doi.org/10.1093/CVR/CVQ309
- Pubchem. (2019). Kaliumnitriet. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Chemische formulering. (2018). Kaliumnitriet. Hersteld van: Quimica -formulering.com
- Nationaal Centrum voor het bevorderen van translationele wetenschappen. (2011). Kaliumnitriet. Hersteld van: drugs.NCAT's.Io
- Richard J. Eliy, Paul B. Addis en Joseph J. Warthheen. (1992). Nitriet in vlees. universiteit van Minnesota.
- N. R. Rao, B. Prakash en m. Natarajan. (1975). Kristalstructuurtransformaties in anorganische nitrieten, nitraten en carbonaten. Afdeling Chemie, Indian Institute of Technology, Kanpur, India.
- « Politieke spraakkenmerken, soorten, kwesties en voorbeelden
- Vervuiling oorzaken, gevolgen en voorbeelden »

