Bradford -methode wat is, principe, reagentia, gebruik

- 2584
- 376
- Hugo Crooks
Hij Bradford -methode Het is een colorimetrische methode die momenteel wordt gebruikt voor een snelle schatting van de totale eiwitconcentratie in biologische experimentenmonsters. Het wordt gebruikt op tal van gebieden van biologisch, medisch, veterinair, agronomisch onderzoek, enz.
Het staat bekend als "Bradford Method" omdat het voor het eerst werd beschreven door Marion Bradford in 1976, in zijn publicatie getiteld Een snelle en gevoelige methode voor de kwantificering van eiwitten in hoeveelheden microgrammen met behulp van het principe van eiwit-jeugdunie.
 Foto van een ELISA-plaquette waar monsters zich hebben voorbereid op een Bradford-kwantificering (Bron: Helito, CC BY-SA 4.0, via Wikimedia Commons)
Foto van een ELISA-plaquette waar monsters zich hebben voorbereid op een Bradford-kwantificering (Bron: Helito, CC BY-SA 4.0, via Wikimedia Commons) Sinds het voorstel is deze methode in de volksmond populair, omdat deze gevoeliger wordt herkend dan andere eiwitkwantificatiemethoden (zoals bijvoorbeeld Lowry en Biuret); stabielere complexe vorm en is economisch en gemakkelijk uit te voeren.
Bovendien is aangetoond dat de reagentia die ze gebruiken zeer weinig interferentie hebben in spectrofotometrische metingen in verschillende omstandigheden.
[TOC]
Methode principe
De methode van Bradford is gebaseerd op de kwantificering van kleurveranderingen in een oplossing vanwege de unie - in zure omstandigheden - van de eiwitmoleculen van een monster met de moleculen van een speciale kleurstof: Coomassie Blue Briljant blauw G250.
Wanneer deze kleurstof wordt toegevoegd aan een eiwitoplossing, bindt deze aan deze moleculen door elektrostatische krachten en deze reactie wordt bewezen als een roodachtig bruine kleurverandering in blauw tot blauw.
Eiwitten en aminozuren
Net zoals het lichaam wordt gevormd door vele cellen en nucleïnezuren (zoals DNA en RNA) worden gevormd door nucleotiden, worden eiwitten gevormd door geordende sequenties van sommige moleculen die bekend staan als aminozuren.
Een aminozuur is een molecuul dat bestaat uit een centraal koolstofatoom waarmee 4 verschillende chemische groepen worden samengevoegd: een waterstofatoom, een carboxylgroep, een aminogroep en een groep of zijketen, die de identiteit geeft.
Er zijn 20 aminozuren die gebruikelijk zijn voor alle eiwitten, die van elkaar verschillen ten opzichte van de eigenschappen van hun zijgroepen: er zijn basisaminozuren, zuren, polaire, apolair, cyclisch, aromatisch, enz.
Kan u van dienst zijn: Shelford's Tolerance Law: wat is en voorbeeldenDe som van de kenmerken van deze aminozuren en de volgorde waarin ze zich aansluiten om de eiwitstructuur te vormen, geeft elk eiwit een reeks van bepaalde fysicochemische kenmerken, of het nu gaat om hun belasting, hun massa, hun hydrofobiciteit, onder andere.
Tint-eiwitcomplex
De methode van Bradford kwantificeert dan de aanwezigheid van aminozuurresiduen van basiskenmerken in biologische monsters, met name aminozuren zoals arginine, lysine en histidine, die degenen zijn die gemakkelijker worden ondergebracht met Coomassie Blue.
Kleurveranderingen worden gekwantificeerd als variaties in de absorptie van de monsters, die wordt gemeten met behulp van een spectrofotometer aangepast aan een golflengte van 595 nm.
Wat is absorptie?
Het is ook bekend als optische dichtheid en definieert de hoeveelheid licht die wordt geabsorbeerd door een oplossing. Deze absorptie hangt af van de golflengte van het licht dat wordt gebruikt om de oplossing te bestralen, omdat niet alle moleculen in staat zijn om dezelfde golflengte te absorberen.
Dit fenomeen werd samengevat in een wet die bekend staat als de wet van Beer-Lambert, die de relatie tot stand brengt tussen de afname van de hoeveelheid licht die door een stof en de eigenschappen van genoemde stof gaat.
Wanneer een licht bijvoorbeeld door een oplossing wordt overgedragen, zijn er twee intensiteitsmaatregelen: een invallende intensiteit (voordat de oplossing wordt gekruist) en een overgedragen intensiteit (in het algemeen lager, wat overeenkomt met de fractie van het licht dat niet werd geabsorbeerd door de oplossing).
De relatie tussen beide waarden is wat bekend staat als verwerking en heeft waarden tussen 0 en 1 of wordt uitgedrukt in procentuele termen.
Absorptie is gerelateerd aan de verwerking van logaritmische manier, en de wet van bier-lambert stelt een lineair verband voor tussen de absorptie van een oplossing en de concentratie ervan, de coëfficiënt van molair uitsterven en de optische coëfficiënt van de oplossing; De wiskundige vergelijking die deze wet beschrijft, is als volgt:
Kan u dienen: schadelijke fauna: oorzaken van proliferatie, gevolgen, controleA (absorptie) = ε (molaire uitstervencoëfficiënt) C (concentratie) L (lichte passlengte)
De concentratie van een oplossing wordt berekend door het opruimen van het onbekende van de vergelijking en het uitvoeren van de relevante berekeningen (c = a/εl)
Wat is een spectrofotometer?
Het is een apparaat dat wordt gebruikt om de hoeveelheid licht (afhankelijk van de golflengte) te kwantificeren die de moleculen absorberen in een oplossing of, met andere woorden, de hoeveelheid licht die ze passeren.
Spectrofotometers werken door een lichtstraal uit te zenden (zichtbaar of ultraviolet) dat door een prisma komt (of een apparaat dat bekend staat als diffractienetwerk monochromator) dat het opsplitst in de verschillende golflengten die het goedmaken, waardoor een bepaalde lengte kan worden "selecteren".
Dit licht wordt door een speciale buis geleid die het monster bevat dat wordt geanalyseerd en vervolgens een detector bereikt die de hoeveelheid licht waarneemt die wordt overgedragen uit het genoemde monster (dat niet is geabsorbeerd) die later kan worden waargenomen dankzij een "tolk" die heeft een grafische interface.
The Dye: Coomassie Blue Briljant blauw G 250
Het belangrijkste reagens van deze methode is zonder twijfel de kleurstof die wordt gebruikt om de eiwitten in het monster te "markeren". Bradford stelde zijn werk voor omdat deze kleurstof op twee manieren bestaat: één rood en één blauw. De rode vorm wordt de blauwe vorm zodra de kleurstof aan een eiwit bindt en een complex vormt.
Het blauw-eiwitblauw complex heeft een zeer hoge molaire uitstervencoëfficiënt, wat resulteert in een grotere gevoeligheid voor de kwantificering van de eiwitconcentratie in de geanalyseerde monsters.
Reagentia
Hoewel de oplossing die wordt gebruikt voor deze kwantificatiemethode in het algemeen op de markt wordt gebracht in gesloten containers, reeds voorbereid -de "Bradford Reactive" -, zijn de belangrijkste gebruikte reagentia:
- Coomassie Blue Briljant blauw G50 (0.01% w/v)
- Fosforzuur (8.5 % w/v)
- Ethanol (4.7% w/v)
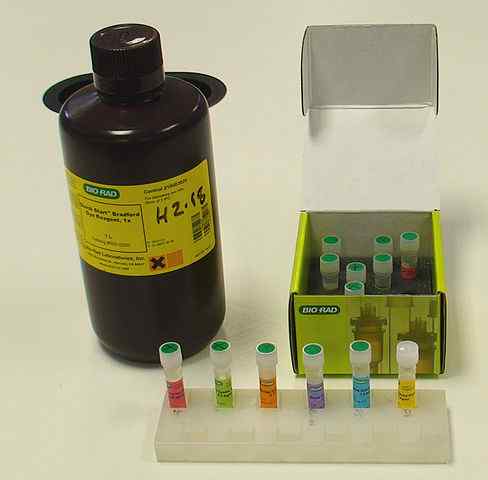 Eiwitkwantificeringskit door Bradford's methode (Bron: Vivo Rolfe, CC BY-SA 4.0, via Wikimedia Commons)
Eiwitkwantificeringskit door Bradford's methode (Bron: Vivo Rolfe, CC BY-SA 4.0, via Wikimedia Commons) Zoals in elke methode en eiwitkwantificeringsprotocol volgens spectrofotometrische methoden, is het noodzakelijk om een "standaard" of "standaard" eiwit te hebben om een kalibratiecurve om de absorptiewaarden te bepalen die verband houden met verschillende eiwitconcentraties; Over het algemeen wordt runderserumalbumine gebruikt.
Kan je serveren: chocolade -agarDe methode bestaat uit het mengen van bepaalde volumes van de monsters probleem met bepaalde delen van het reagens van Bradford; Wacht een paar minuten op kleurstof-eiwit interactie en kleurverandering is duidelijk en is vervolgens gemeten en registreer de absorptiewaarden om latere berekeningen uit te voeren.
Gebruik/toepassingen
De methode van Bradford is een van de kwantificerings- of schattingsmethoden van de meest gebruikte eiwitconcentratie ter wereld, voornamelijk vanwege de lage kosten, tot de snelheid waarmee de resultaten worden verkregen, tot de grote stabiliteit tussen het eiwit en de gebruikte kleurstof, de reproduceerbaarheid ervan en de minimale interferentie die de componenten van de reagentia die tijdens de meting worden gebruikt, hebben.
De methode wordt gebruikt in honderden verschillende wetenschappelijke toepassingen voor de bepaling van eiwitten in verschillende contexten: fysiologische, cytologische, immunologische, klinische, industriële (met name in de voedingsindustrie), enz.
Experimenteel is deze methode erg handig voor:
- Controleer de hoeveelheid eiwitten in de volumes die geleidelijk worden verkregen uit een chromatografische kolom (in affiniteitskolommen, ionenuitwisseling, absorptie, gelfiltratie, onder andere) i i.En. Analyseer fracties van protocollen van eiwitzuivering.
- Controleer de hoeveelheid eiwitten die in een gel wordt geladen voor elektroforese.
- Schat de hoeveelheid eiwitten die is verkregen in een overexpressiesysteem.
Referenties
- Bonjoch, n. P., & Tamayo, p. R. (2001). Kwantificering van eiwitgehalte door Bradford -methode. In Handbook of Plant Ecophysiology Techniques (PP. 283-295). Springer, Dordrecht.
- Bradford, m. M. (1976). Een snelle en gevoelige methode voor de kwantificering van microgramhoeveelheden eiwit met behulp van de belangrijkste binding van eiwitdag. Analytical Biochemistry, 72 (1-2), 248-254.
- KiELKOPF, C. L., Bauer, W., & Urbatsch, ik. L. (2020). Bradford -test voor het bepalen van de eiwitconcentratie. Cold Spring Harbor Protocols, 2020 (4), PDB-prot102269.
- Sapan, c. V., Lundblad, r. L., & Prijs, n. C. (1999). Colorimetrische eiwitassaytechnieken. Biotechnologie en toegepaste biochemie, 29 (2), 99-108.
- Walker, J. M. (ED.)). (1996). Het handboek van eiwitprotocollen (vol. 1996). Springer Science & Business Media.

