Dalton Atomic Model

- 4849
- 794
- Lonnie Rohan
We leggen het atoommodel van Dalton uit, zijn postulaten en beperkingen
 Het atoommodel van Dalton was de eerste die gebaseerd was op wetenschappelijk onderzoek. Bron: f. Zapata.
Het atoommodel van Dalton was de eerste die gebaseerd was op wetenschappelijk onderzoek. Bron: f. Zapata. Wat is het atoommodel van Dalton?
Hij Dalton Atomic Model Het stelt voor dat alle materie bestaat uit kleine en ondeelbare eenheden, atomen genoemd, waardoor de ideeën worden hersteld die voormalige Griekse denkers tweeduizend jaar geleden hadden geformuleerd.
Het is het eerste atoommodel dat voortkwam uit een zorgvuldige experimenten in het laboratorium, want hoewel de mensheid altijd heeft geprobeerd te begrijpen wat de materie is, waren de mogelijkheden om de theorieën tot het begin van de negentiende eeuw te begrijpen, nog steeds beperkt.
Afgezien van het feit dat het een goede natuurwaarnemer was, viel de Engelse leraar John Dalton (1766-1844) echter ook op op het gebied van instrumentatie, omdat hij verschillende meetapparaten creëerde, die hij later in zijn laboratorium zou gebruiken voor de studie van de studie van de studie van de studie van de studie van de studie van de studie van de studie van de studie van de studie van de studie van de studie van de studie van de studie van de studie gassen.
Dalton realiseerde zich dus dat stoffen worden gecombineerd volgens bepaalde regels, en om het uit te leggen, postuleerde hij dat alle materie bestond uit atomen, kleine, homogene sferen en geen interne structuur. Atomen, zei hij, vormen verbindingen na bepaalde verhoudingen, en tijdens een chemische reactie scheiden ze en combineren ze opnieuw, waardoor nieuwe verbindingen ontstaan.
Dalton ontwikkelde niet alleen het eerste atoommodel op basis van rigoureuze experimenten. Hij creëerde ook een nomenclatuursysteem voor de elementen, beval ze voor hun atoomgewicht, vestigde de wet van meerdere verhoudingen, de wet van gedeeltelijke druk en beschreef blindheid voor bepaalde kleuren, een aandoening die hij zelf leed, genoemd, genoemd kleurenblind.
Zijn uitgebreide bijdragen aan de wetenschap verdienden talloze onderscheidingen gedurende zijn wetenschappelijke carrière, maar Dalton leefde altijd op een bescheiden en eenvoudige manier, gewijd aan de wetenschap tot het einde van zijn dagen.
Kort verhaal
Sinds de afstandsbediening heeft de mensheid een verklaring gezocht over de aard van de materie. Griekse denkers uit de 5e eeuw.C, en voordat zij, sommige hindoe -filosofen, stelden dat de zaak werd gevormd door elementaire eenheden die atomen worden genoemd. Ze misten echter de nodige experimentele ondersteuning om hun theorieën te verifiëren.
Kan u van dienst zijn: wat zijn de thermische eigenschappen en wat zijn? (Met voorbeelden)Het eerste atoommodel wordt toegeschreven aan Leucipo en zijn Democritus -discipel van Abdera (460 tot. C. - 370 a. C.)). Van het eerste kleine is het bekend, maar Democritus was een salie van grote gerenommeerde, vergelijkbaar met Plato en Aristoteles, hoewel een paar fragmenten van zijn werk nauwelijks worden bewaard.
Democritus bedacht het atoom als het ultieme deeltje dat de zaak vormt, ondeelbaar en onverwoestbaar. Volgens hun theorieën bestond alle materie uit deze deeltjes, te klein om te worden gezien. En volgens de manier van combineren, gaf atomen het onderwerp hun karakteristieke eigenschappen.
In tegenstelling hiermee, na commentaar. De voortdurende ideeën van Aristoteles hebben uiteindelijk de overhand gehad tot het begin van de 19e eeuw.
Dalton's werken
In 1793 was John Dalton geïnteresseerd in meteorologie en ging werken in de studie van atmosferische gassen en hun eigenschappen. Dankzij zijn experimenten realiseerde hij zich dat elementen zoals zuurstof, altijd in een bepaald deel gecombineerd, gegeven door een geheel getal.
In 1803 legde Dalton uit dat deze verhoudingen te wijten zijn aan het feit dat de zaak bestaat uit basisdeeltjes, atomen genoemd, zoals Democrit lang geleden zei. Hij presenteerde zijn voorstel in het werk "Nieuw systeem van chemische filosofie", waarin hij de resultaten van zijn experimenten beschreef.
Bovendien omvatte in dat werk ook speciale symbolen om de individuele atomen van elk element weer te geven, waardoor de grondslagen van de moderne chemie werden gelegd.
Kan u van dienst zijn: acute geluiden: kenmerken en voorbeeldenVerklaring van het Dalton Atomic Model
In de tijd dat Dalton zijn werk ontwikkelde, hadden andere wetenschappers al enkele van de wetten ontdekt die het onderwerp regelen en de combinaties tussen de elementen: Antoine Lavoisier heeft vastgesteld dat, tijdens een chemische reactie, de massa niet wordt gecreëerd of vernietigd, maar dat wordt.
Deze wet werd gevolgd door de wet van Proust over de gedefinieerde proporties, waaruit bleek dat, wanneer twee elementen worden gecombineerd, ze dit altijd doen in vaste proporties.
Nu bestond een deel van de experimenten van Dalton uit het bestuderen van de absorptie van water in het water. Daar merkte hij op dat een bepaald volume water alleen een bepaalde hoeveelheid gas kon absorberen, en dat die hoeveelheid varieerde volgens het gas. Bovendien kan gas worden teruggevonden uit water, waardoor de eigenschappen intact worden gehouden.
Hij had ook ontdekt dat wanneer twee elementen kunnen worden gecombineerd om meer dan één verbinding te ontstaan, de hoeveelheid van elk gefixeerd blijft en een eenvoudige numerieke relatie bijhoudt, bijvoorbeeld 1: 1, 1: 2; 2: 3 enzovoort. Dit is de oproep Wet van meerdere verhoudingen.
Om deze feiten uit te leggen, betoogde Dalton dat gas, water en in het algemeen alle materie bestaat uit basisstukken, die, indien gecombineerd, aanleiding geven tot verschillende verbindingen. Elk element bestaat uit onderscheidende deeltjes (Dalton noemde ze in het begin geen atomen), maar zelfs in combinatie behouden dergelijke deeltjes hun ongewijzigde kwaliteiten.
Het atoommodel van Dalton postuleert
Het atoommodel van Dalton is samengevat in de volgende verklaringen:
1. Materie wordt gevormd door kleine ondeelbare deeltjes die atomen worden genoemd.
2. Elk element bestaat uit identieke atomen met elkaar en met gelijke eigenschappen. De atomen van een element verschillen van die van anderen.
3. Door twee of meer atomen van verschillende elementen samen te voegen, doen ze dit in bepaalde en eenvoudige verhoudingen, waardoor de verbindingen worden gecreëerd, gevormd door moleculen. De moleculen van een bepaalde verbinding zijn identiek aan elkaar.
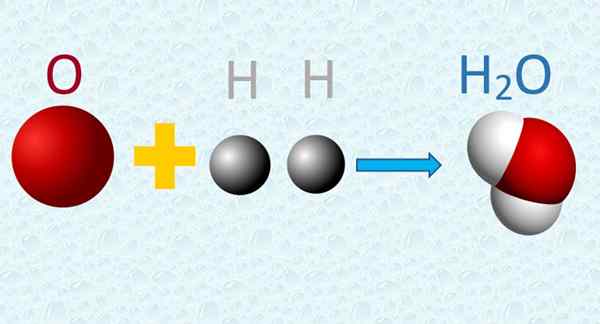 In een watermolecuul worden zuurstof- en waterstofatomen in eenvoudige verhoudingen gecombineerd. Bron: f. Zapata.
In een watermolecuul worden zuurstof- en waterstofatomen in eenvoudige verhoudingen gecombineerd. Bron: f. Zapata. 4. Tijdens een chemische reactie worden atomen uitgewisseld, maar ze lijden geen transformatie, noch worden ze gecreëerd of vernietigd in het proces.
Dalton Model Failures
Wetenschappelijk onderzoek beleefde een opmerkelijke boom in de negentiende eeuw, gepromoot door de industriële revolutie. En de belangrijkste mislukkingen van het atoommodel van Dalton werden niet onthuld:
Kan u van dienst zijn: grensvlakspanning: definitie, vergelijking, eenheden en meting1. Het atoom is niet ondeelbaar
Dit is een van de belangrijkste mislukkingen van het atoommodel van Dalton. De experimenten die tijdens de negentiende en twintigste eeuw zijn uitgevoerd, toonden aan dat het atoom bestaat uit een veelheid van subatomaire deeltjes.
De eerste die elkaar kende, waren het elektron en het proton, en later werd het geleerd over het bestaan van het neutron. Vervolgens onthulden zowel het proton als het neutron zijn interne structuur.
2. Atomen van hetzelfde element zijn mogelijk niet identiek
De elementen hebben isotopen die, hoewel ze dezelfde chemische eigenschappen hebben, verschillen in het aantal neutronen, dus hun atoomgewicht is anders. Waterstofisotopen zijn bijvoorbeeld protio, deuterium en tritium.
3. Atomen zijn niet onveranderlijk
Er zijn radioactieve stoffen die deeltjes en energie uitzenden, die transformeren in andere elementen.
4. Atomen combineren niet altijd in volledige verhoudingen
Het is bewezen dat er organische, meer complexe verbindingen zijn, die niet precies de wet van Dalton van meerdere verhoudingen volgen.
Interessante artikelen
Schrödinger atomair model.
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atomic Model.
Thomson Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Leucipo -atoommodel.
Bohr Atomic Model.
Rutherford Atomic Model.
Huidig atoommodel.
- « De 50 beroemdste Mexicaanse schrijvers in de geschiedenis
- Verschillen tussen wetenschap en technologie »

