Alkalische metalen fysische en chemische eigenschappen, gebruik, verkrijgen
- 5029
- 1079
- Miss Herman Russel
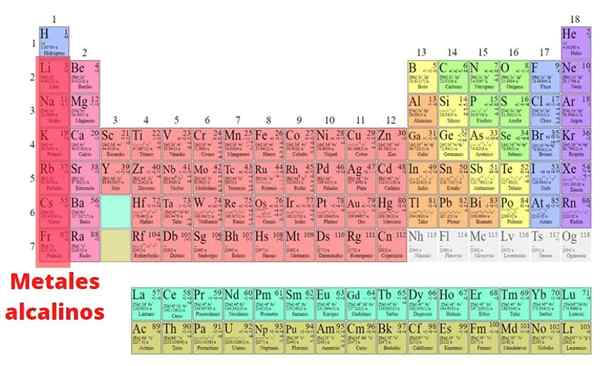
De alkalimetalen Dit zijn de elementen die deel uitmaken van groep I van het periodiek systeem, behalve waterstof: lithium (Li), natrium (NA), kalium (k), rubidid. In tegenstelling tot de meeste metalen hebben ze lage dichtheden en zijn ze erg reactief. Vanwege deze geweldige chemische reactiviteit worden ze nooit in de natuur gevonden in hun elementaire vorm.
Deze metalen vormen eenvoudige en stabiele ionische verbindingen die voor het grootste deel oplosbaar zijn in water; Alkalische metalen worden meestal gecombineerd met halogenide, sulfaat, carbonaat en silicaationen. Sommige elementen vormen echter een beperkt aantal complexe en organomethalische verbindingen.

Over het algemeen zijn de fysische en chemische eigenschappen van alkalische metalen goed bestudeerd, behalve Francio vanwege de radioactieve aard.
[TOC]
Fysieke eigenschappen
- Alkalische metalen zijn zilver, behalve cesium, wat goud is. Ze leiden elektriciteit en warmte, en hebben lage smeltpunten die ook afnemen met de toename van het atoomnummer, omdat het verband tussen atomen wordt verzwakt door toenemende atoomradius.
- Het feit dat slechts één elektron van Valencia door Atom is, maakt zijn metaalbinding ook zwak. Bijgevolg zijn alkalische metalen ook zacht genoeg om ze te snijden met een mes of een spatel.
- Alle elementen nemen een kubieke structuur aan die op het lichaam is gecentreerd. Omdat dit type kristallijne structuur niet is verpakt en de atomaire radio's van alkalische metalen groot zijn, hebben ze lage dichtheden in vergelijking met andere metalen. In feite drijven lithium, natrium en kalium in water.
- Energieverschillen tussen de orbitalen van de Valencia -laag van alkalische metalen vallen samen met golflengten van zichtbaar licht. Daarom worden bij het verwarmen van de verbindingen die door deze metalen worden gevormd in een vlam, karakteristieke kleuren gegenereerd.
Het kan u van dienst zijn: Trinitrotolueno (TNT): structuur, eigenschappen, gebruik, risico's, explosie- In afnemende volgorde geven lithiumzouten een karmozijnrode kleur, natriumzouten een gele kleur, kalium een violette kleur, rubidium een blauwachtige rode kleur en stopt een blauwe kleur.
Chemische eigenschappen
Alle alkalische metalen hebben overeenkomsten in hun chemische eigenschappen.
- Ze hebben een elektronische configuratie van Valencia NS1, die zich vertaalt in een oxidatietoestand +1. Op zijn beurt betekent dit dat ze gemakkelijk een elektron verliezen om adellijke gasconfiguratie te bereiken.
- In het algemeen hebben alkalische metalen de laagste ionisatie -energieën van alle elementen, die ook afnemen naarmate de atoomradius toeneemt in de groep omdat de Valencia -laag steeds ver weg is van de kern. Dit verklaart de reactiviteit van alkalische metalen en de vorming van m+ ionen in gemakkelijk waterige omstandigheden.
- De thermodynamische neiging om m+ ionen te vormen wordt bevestigd door de standaardpotentialen van m+/m paren, die allemaal groot en negatief zijn. Een dergelijke trend houdt in dat alkalische metalen gemakkelijk oxideren en kunnen fungeren als krachtige reductiemiddelen.
- Deze elementen moeten worden opgeslagen in een niet -reactieve olie om reactie met atmosferische zuurstof te voorkomen. Hoewel lithium, natrium en kalium voor korte periodes in de lucht kunnen worden gemanipuleerd, moeten rubidium en cesium te allen tijde onder een inerte atmosfeer worden behandeld.
Alkalische metalen verkrijgen
Natrium

De beste manier om metallisch natrium te verkrijgen, omvat elektrolyse van gesmolten natriumchloride. Omdat het smeltpunt van natriumchloride vrij hoog is (808 ° C) en veel energie vereist is om grote hoeveelheden gesmolten stof te behouden, wordt calciumchloride (CACL2) meestal toegevoegd om het smeltpunt te verminderen tot ongeveer 600 ° C.
Kan u van dienst zijn: turbidimetrieNatrium wordt verkregen in een vloeibare toestand in de kathode met een zuiverheid van 99,95% onder een inerte atmosfeer.
Lithium en kalium
Lithium kan ook worden verkregen uit zijn chloriden gegoten door elektrolyse, maar het is niet het geval van kalium omdat het te oplosbaar is in chloride (KCL) en niet op het oppervlak van de cel drijft. Bovendien verdampt het gemakkelijk tot de bedrijfstemperatuur, dus het creëert gevaarlijke omstandigheden.
Daarom wordt kalium verkregen door reductie van gesmolten KCl met vloeibaar natrium. Het natrium aanwezig in kalium wordt geëlimineerd door de stoom bij 892 ° C te condenseren en een fractionele destillatie van vloeibare metalen uit te voeren.
Rubidio en Cesio
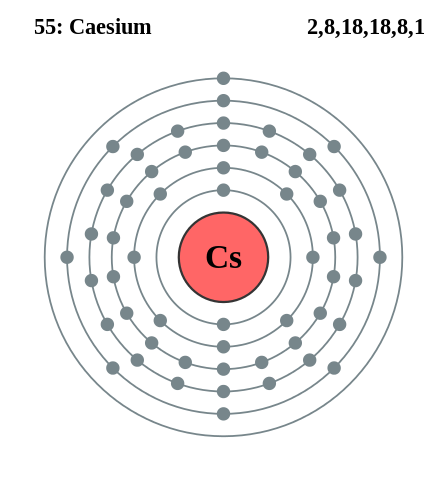 Elektronische cesiumconfiguratie. Bron: Pumbaa (origineel werk van Greg Robson) / CC BY-SA 2.0 uk (https: // creativeCommons.Org/licenties/by-sa/2.0/UK/akte.in)
Elektronische cesiumconfiguratie. Bron: Pumbaa (origineel werk van Greg Robson) / CC BY-SA 2.0 uk (https: // creativeCommons.Org/licenties/by-sa/2.0/UK/akte.in) Rubidio en cesium kunnen op dezelfde manier worden verkregen, maar calcium gebruiken als een reductiemiddel. Metallisch stop kan ook worden verkregen door gesmolten cesiumcyanide -elektrolyse (CSCN).
Hoofdgebruik en toepassingen
Natrium als een reductiemiddel
Omdat natrium heel gemakkelijk wordt geoxideerd, is de belangrijkste toepassing ervan als een reductiemiddel om metalen zoals titanium, surround en hafnio te verkrijgen. Het wordt ook gebruikt als een warmtewisselaar in kernreactoren in zijn vloeibare toestand.
Kalium als meststof
 Kaliumchloride, een meststof. Bron: Abbas cucaniensis/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0)
Kaliumchloride, een meststof. Bron: Abbas cucaniensis/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0) Het grootste deel van het verwerkte kalium gaat naar meststoffen in de vorm van kaliumchloride. Op zijn beurt wordt chloride gebruikt bij de productie van andere verbindingen en oplossingen zoals kaliumhydroxide, die wordt gebruikt bij de vervaardiging van vloeibare zeep.
Kaliumcyanide wordt gebruikt voor metaalextractie of coating om koper-, zilver- en gouden depositie te vergemakkelijken. Kalium is ook te vinden in sommige explosieven en als vuurwerkkleuringen.
Kan u van dienst zijn: radio: structuur, eigenschappen, gebruik, verkrijgenLithium als legeringsagent
Metallic lithium wordt gebruikt als een legeringsagent bij de productie van aluminium- en magnesium -luchtvaart- en ruimtevaartlegeringen. Maar met het verstrijken van de tijd heeft het een toenemend nut gevonden als een alkalische batterijanode.
Metallic lithium maakt het ook mogelijk om de smelt- en sintertemperaturen van bepaalde soorten glas en keramiek te verminderen, naast het verlagen van de expansiecoëfficiënt. Lithiumcarbonaat wordt veel gebruikt om bipolaire aandoeningen te behandelen, terwijl lithiumstearaat een smeermiddel is dat veel wordt gebruikt in de auto -industrie.
Rubidio en Cesio
Rubidio en cesium worden meestal in dezelfde toepassingen gebruikt, dus een van deze elementen kan door de andere worden vervangen. Toepassingen omvatten glasvezelglas in de telecommunicatie -industrie, nachtzichtapparatuur en foto -elektrische cellen. De Cesio Clock (Atomic Clock) wordt gebruikt voor de internationale standaardtijdmaatregel en voor de definitie van de tweede.
Referenties
- Chang, R., & Goldsby, K. NAAR. (2016). Chemie (12e ed.)). New York: Mc-Graw Hill.
- Halka, m., & Nordstrom, B. (2010). Alkali en alkalische aardmetalen. New York: Infobase Publishing.
- Miesler, g. L., Fischer, p. J., & Tarr, D. NAAR. (2014). Anorganische chemie (5e ed.)). New York: Pearson.
- Mishra, B., & Majumdar, g. (2017). Alkali metalen productie (Li, NA, K). Referentiemodule in materiaalwetenschap en materiaaltechniek. Elsevier.
- Petrucci, r. H., Haring, f. G., Bissonnette, c., & Volwassen, j. D. (2017). Algemene chemie: principes en moderne toepassingen (11e ed.)). New York: Pearson.
- Shriver, D., Weller, m., Overton, T., Rourke, J., & Armstrong, f. (2014). Anorganische chemie (6e ed.)). New York: W. H. Freeman.
- « In welk continent is er een grotere bevolkingsconcentratie?
- Bronstijdige kenmerken, periodes, tools en uitvindingen »

