De functies en typen
- 1348
- 301
- Alton D'Amore
De liasas Het zijn enzymen die deelnemen aan de snede of de toevoeging van groepen in een chemische verbinding. Het principe van deze reactie is gebaseerd op de snede van C-C-, C-O- of C-N-links. Bijgevolg worden nieuwe dubbele bindingen of ringstructuren gevormd (Mahdi en Kelly, 2001).
Aan de andere kant nemen LIASA's deel aan cellulaire processen zoals de cyclus van citroenzuur en organische synthese, zoals de productie van cyanohydrin.
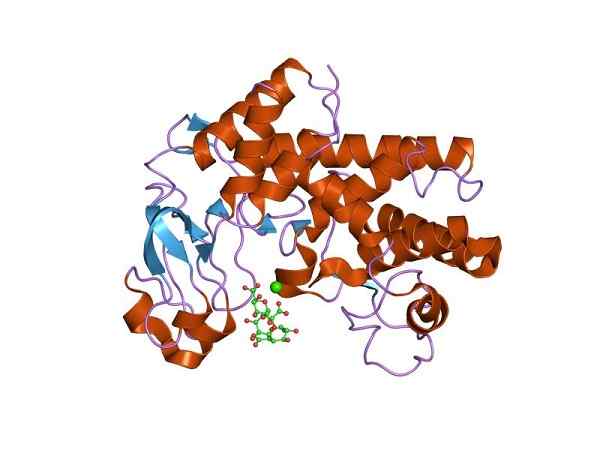
 Drie -dimensionale structuur van Liasa polygalacturonzuur (Liasa Pectate). Door Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain (https: // creativeCommons.org/licenties)], van Wikimedia Commons.
Drie -dimensionale structuur van Liasa polygalacturonzuur (Liasa Pectate). Door Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain (https: // creativeCommons.org/licenties)], van Wikimedia Commons. Deze eiwitten verschillen van andere enzymen, omdat ze bepaalde speciale details presenteren. In een gevoel van de reactie werken ze op twee substraten, terwijl ze in de tegenovergestelde richting slechts één substraat beïnvloeden.
In feite veroorzaakt het effect ervan de eliminatie van een molecuul, dat een dubbele bindingsstructuur of het uiterlijk van een nieuwe ring produceert. In het bijzonder, het Liasa polycalacturonzuur enzym (Liasa pectaat), dat de pectine breekt en eenvoudige eenheden van Galacturonic, Ramnosa en dextrinezuur ontstaat. Bovendien is het aanwezig in sommige schimmels en fytopathogene bacteriën.
[TOC]
Functies van de liasa's
Liasa's zijn een interessante enzymgroep, die veel artikelen hebben in het leven van onze planeet. Het zijn dus protagonisten van belangrijke processen voor het leven van organismen.
Dat wil zeggen, het ontbreken van deze eiwitten veroorzaakt de dood van wezens. Hoe dan ook, de kennis van deze eiwitten is leuk en schokkend. Aan de andere kant leert het de complexiteit van de processen die ons omringen.
Bovendien variëren de functies afhankelijk van het type liasa. Bijgevolg is er een breed scala aan enzymen met LIASA -activiteit. Op een zodanige manier dat ze in staat zijn om sneden te maken in de links van zeer variabele moleculen.
Aan de andere kant, laten we enkele voorbeelden bekijken van deze eiwitten en de functies die ze uitvoeren:
Kan je van dienst zijn: herpetologie: geschiedenis, collecties, herpetoloogfunctieFosfolipase C van Bacillus SP
Biedt dit lichaam de mogelijkheid om het spijsverteringssysteem van sommige insecten te wijzigen. Daarom is het voorstander van zijn snelle vermenigvuldiging door het lichaam van het dier.
Koolhydrase
Converteer koolstofdioxide in bicarbonaat en protonen. In aanwezigheid van water is het gerelateerd aan het behoud van de zuurbasisbalans in het bloed en in weefsels, evenals bij de snelle eliminatie van de koolstofdioxide hiervan.
Dit enzym in planten verhoogt echter de concentratie van koolstofdioxide in chloroplast, wat de carboxylering van het Rubisco -enzym verhoogt.
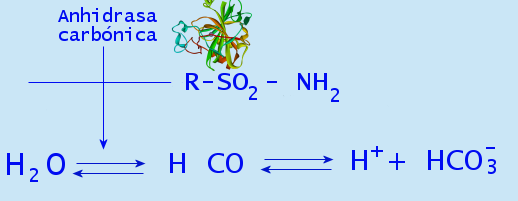
Reactie gekatalyseerd door koolhydrase. Door Garciagerry [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/)], van Wikimedia Commons.
Versterken
Zet 2-fosfoglycerate om in fosfoenolpyruvaat in glycolyse. Evenals, u kunt de omgekeerde reactie in gluconeogenese uitvoeren. Uiteraard probeert het glucose te synthetiseren wanneer er een tekort is van deze suiker in de cellen.
Naast deze klassieke functies is enolase aanwezig in zenuwcelaxonen. Het is ook een marker voor neuronale laesies en andere schade aan het zenuwstelsel.
Carboxylase
Als gevolg van zijn werking elimineert het carboxylgroepen uit pyruvinezuur. Bijgevolg maakt het ethanol en koolstofdioxide.
Vernietig in gisten de CO2 van de cellen en origineer ethanol. Deze verbinding werkt als een antibioticum.
Fosfolipase C
Het bevindt zich in de membranen van de tripanosomen en een verscheidenheid aan bacteriën. Genereert de eiwitsnede van de GPI die aanwezig is in deze membranen. In feite is het in Trypanosoma Brucei.
Pepck
Het komt tussenbeide in gluconeogenese, omzet oxalacetaat in fosfoenolpyruvaat en koolstofdioxide. Aan de andere kant kan bij dieren lever- of niercellen glucose vormen van andere metabolieten.
Aldolase
Het oefent zijn werking uit in glycolyse; Snijd de fructose-1,6-bf in twee Triosas, Dhap en glyceraldehyde 3-fosfaat. Daarom speelt dit enzym in het cytosol van de meeste organismen een belangrijke rol bij de extractie van suikerergie.
Het kan u van dienst zijn: koraalriffen: kenmerken, formatie, typen, flora, faunaAan de andere kant is de evaluatie van bloed (of serum) aldolase een hulpmiddel waarmee de beschadigde structuren in organen zoals de lever, spieren, nier of hart kunnen worden bepaald.
Liasa huur
Het oefent zijn werking uit op een alkary-mercury-substraat en waterstofionen, om een alkaan- en kwikionen te produceren.
De fundamentele biologische rol is om deel te nemen aan toxische eliminatiemechanismen, omdat het organische kwikverbindingen omzet in middelen die niet schadelijk zijn.
Oxalomalaat liasa
In het bijzonder transformeert het 3-oxomalaat in twee producten: oxoacetaat en glixilaat.
Het werkt in de Krebs -cyclus, zodat schimmels, protisten en planten suikers vormen van acetaten uit het medium.
Soorten liasa's
Binnen de LIASAS -groep zijn er verschillende subklassen:
Liases koolstofarbon
Deze enzymen snijden koolstof-koolstofbindingen. Ze zijn geclassificeerd als de volgende typen:
- Carboxy-Liasas: die COOH toevoegen of verwijderen. In het bijzonder verwijderen ze aminozuurgroepen, van het alfa-zo-zuur en bèta-ecoto-zuur type.
- Cho-Liasas: Condense aldolgroepen in de omgekeerde zin.
- Ox liasas zuur: Ze snijden de zuur 3-roh of omgekeerde reacties.
Liasa's cArbon-OXigen
Deze enzymen breken c-o links. Ze zijn tussen hen:
1) Hydrolysa, die water elimineert. Zoals ze zijn, onder andere carbonaat of de-hydratasa-citraat, fumaraathydratasa, onder andere eiwitten.
2) liasas, die suikeralcohol nemen. Heparin Liasa, Pectato Liasa, Glucuronan Liasa worden gevonden, naast vele andere enzymen (Albersheim 1962, Courtois 1997).
3) LIASA's die hun werking uitoefenen op fosfaatsubstraten en fosfaat verwijderen.
Koolstof-nitrogenen
Het is duidelijk dat het enzymen zijn die koolstof-nitrogenen vakbonden snijden. Ze zijn verdeeld in:
1) LIASAS ammonium, die koolstof-nitrogene junctions breken en NH3 vormen. Wiens werking op aspartaat, Treonine of Histidine is.
Kan u van dienst zijn: chemotropisme2) Bovendien zijn er LIASA's die C-N-verbindingen in amidas of amidines snijden. Adenylosuccinate liasa bijvoorbeeld.
3) amino-liasas, snijdt koolstof-nitrogenen vakbonden in aminegroepen. Op zo'n manier dat strikte Syntasa Sidine, Deacel ipecosido syntasa, in deze groep enzymen bevindt.
Liasas Carbon-Azufre
Het zijn enzymen die bindingen van koolstof-suiker snijden. Liasa Cysine, Lactailltiona Liasa of γ-Liasa Methodine bijvoorbeeld bijvoorbeeld.
Liasas koolstof-halogenuro
Eerst werd deze subklasse oorspronkelijk vastgesteld op basis van het enzym van eliminatie van zoutzuur (HCL) van 1,1,1-truso-22.2-bis-eeto (DDT).
Fosfor-zuurstof
Fosfolipase C wordt gevonden in deze categorie liasas.
Legt koolstof-fosfor
In het bijzonder oefenen ze hun werking uit op koolstof-fosfor-vakbonden.
Referenties
- Mahdi, J.G., Kelly, D.R., 2001. Lyes. In: Rehm, h.-J., Reed, G. (Eds.), Biotechnology set. Wiley-VCH Verlag GmbH, Weinheim, Duitsland, PP. 41-171.
- Palomeque p., Martínez M., Valdivia e. en maqueda m. (1985). Voorlopige studies van het entomotoxische effect van Bacillus latrosporus voor larve. Schaal. Doen. Pests, 11: 147-154.
- LaFrance-Vanasse, J.; Lefebvre, m.; Di lello, p.; Sygusch, J.; Omichinski, J. G. (2008). Kristalstructuren van de organomeriale lyase merb in zijn vrije en kwikgebonden vormt inzichten in het mechanisme van de afbraak van methylkwiks. JBC, 284 (2): 938-944.
- Kondrashov, Fyodor A; Koonin, Eugene V; Morgunov, Igor G; Finogenova, Tatiana V; Kondrashova, Marie N. (2006). Evolutie van glyxilaatcyclus -enzymen in metazoa: bewijs van horizontale meerdere transfers en pseudogene vorming. Biologie Direct, 1:31.
- Albersheim, p. en Killias, u. (1962). Studies met betrekking tot de zuivering en eigenschappen van pectine -transeliminase. Boog. Biochem. Biophys. 97: 107-115.
- Courtois B, Courtois J (1997). Identificatie van glucuronan lyase uit een mutante stam van Rhizobium meliliti. Inteken. J. Biol. Macromol. 21 (1-2): 3-9.

