Charles Law -formules en eenheden, experimenteren, oefeningen

- 3586
- 277
- Kurt Aufderhar Jr.
De Charles Law of van Guy-Lussac is er een die de verklaring mogelijk maakt van een van de eigenschappen van de gasvormige toestand: het volume dat een gas in beslag neemt, is recht evenredig met de temperatuur bij constante druk.
Deze evenredigheid is lineair voor alle temperaturen als het gas in kwestie ideaal is; Koninklijke gassen wijken daarentegen van de lineaire trend bij temperaturen dicht bij hun condensatiepunt. Dit heeft het gebruik van deze wet echter niet beperkt voor eindeloze toepassingen waar gassen deelnemen.
 Chinese lantaarns of wensen. Bron: Pxhere.
Chinese lantaarns of wensen. Bron: Pxhere. Een van de bijtreffelijkheid van de wet van Charles is aanwezigheid in aerodynamische ballonnen. Andere eenvoudigere ballonnen, zoals verlangens, ook wel Chinese lamp genoemd.
Waarom constante druk? Omdat als de druk zou stijgen, dit zou betekenen dat de container waar het gas zich bevindt strak gesloten is; En daarmee zouden de botsingen of effecten van de gasvormige deeltjes tegen de interne wanden van de genoemde container (Boyle-Maleotte-wet) de botsingen of effecten van de interne deeltjes (Boyle-Maleotte-wet) vergroten.
Daarom zou er geen verandering zijn in het volume bezet door gas, en de wet van Charles zou niet streng zijn. In tegenstelling tot een hermetische container, vertegenwoordigt het weefsel van de ballonnen van de verlangens een mobiele barrière, in staat om uit te breiden of te samentrekken, afhankelijk van de druk die door het gas binnen wordt uitgeoefend.
Wanneer het ballonweefsel echter groeit, blijft de interne druk van het gas constant omdat het het gebied verhoogt waarover zijn deeltjes botsen. Hoe hoger de gastemperatuur, hoe groter de kinetische energie van de deeltjes, en daarom het aantal botsingen.
En wanneer de wereldbol weer uitbreidt, blijven botsingen tegen de interne muren constant (idealiter).
Dus, hoe heter het gas is, hoe groter de uitbreiding van de wereld en hoe meer het zal stijgen. Het resultaat: roodachtige (hoewel gevaarlijke) lichten die in de nacht in december in de hemel zijn opgeschort.
[TOC]
Wat is de wet van Charles?
Stelling
De zogenaamde Charles Law of de wet van gay-lussac verklaart de afhankelijkheid die bestaat tussen het volume dat wordt bezet door een gas en de waarde van zijn absolute temperatuur of kelvinetemperatuur.
De wet kan als volgt worden uitgewerkt: als de druk constant blijft, wordt het vervuld dat “voor een gegeven massa van een gas zijn volume verhoogt met 1/273 keer ongeveer het volume tot 0 ºC, voor elke graad Celsius (1 ºC (1 ºC (1 ºC (1 ºC (1 ºC (1 ºC (1 ºC (1 ºC (1 ºC (1 ºC verhoogt. ) dat verhoogt zijn temperatuur ".
Banen
De onderzoekswerken die het mogelijk maakten om de wet te vestigen, werden in de jaren 1780 geïnitieerd door Jacques Alexander Cesar Charles (1746-1823). Charles publiceerde echter niet de resultaten van zijn onderzoek.
Vervolgens wist John Dalton in 1801 experimenteel te bepalen dat alle gassen en dampen, bestudeerd door hem, uitzetten tussen twee vastgestelde temperaturen in hetzelfde volume. Deze resultaten werden bevestigd door Gay-Lussac in het jaar 1802.
De onderzoekswerken van Charles, Dalton en Gay-Lussac, mochten vaststellen dat het volume bezet door een gas en zijn absolute temperatuur recht evenredig zijn. Daarom is er een lineair verband tussen de temperatuur en het volume van een gas.
Het kan u van dienst zijn: methoden voor scheiding van heterogene mengselsGrafiek
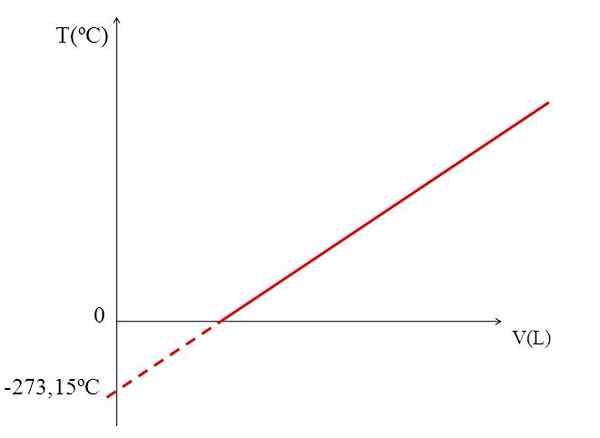 T vs v grafiek voor een ideaal gas. Bron: Gabriel Bolívar.
T vs v grafiek voor een ideaal gas. Bron: Gabriel Bolívar. De realisatie van een grafiek (bovenste afbeelding) van het volume van een gas tegen de temperatuur produceert een rechte lijn. Het snijpunt van de lijn met de as van de X, bij de temperatuur van 0 ºC, maakt het mogelijk om het volume gas te verkrijgen bij 0 ºC.
Evenzo zou de kruising van de lijn met de as van de X informatie geven over de temperatuur waarvoor het volume bezet door het gas nul "0" zou zijn. Dalton schatte deze waarde op -266 ºC, dicht bij de waarde voorgesteld door Kelvin voor absoluut (0) absoluut.
Kelvin stelde een temperatuurschaal voor waarvan de nul de temperatuur zou moeten zijn waarbij een perfect gas een volume van nul zou hebben. Maar bij deze lage temperaturen worden de gassen vloeibaar gemaakt.
Dat is de reden waarom we niet kunnen praten over volumes van gassen als zodanig, en constateren dat de waarde voor absolute nul -273.15 ºC moet zijn.
Formules en meeteenheden
Formules
De wet van Charles in zijn moderne versie geeft aan dat het volume en de temperatuur van een gas direct evenredig zijn.
Dus:
V / t = k
V = gasvolume. T = Kelvin -temperatuur (K). K = evenredigheid constant.
Voor een volume v1 en een temperatuur T1
K = V1 / T1
Ook voor een deel V2 en een temperatuur T2
K = V2 / T2
Vervolgens bij de twee vergelijkingen voor K die je hebt
V1 / T1 = V2 / T2
Deze formule kan als volgt worden geschreven:
V1 · T2 = V2 · T1
Opruimen V2, De formule wordt verkregen:
V2 = V1 · T2 / T1
Eenheden
Het volume gas kan worden uitgedrukt in liters of in een van de afgeleide eenheden. Evenzo kan het volume worden uitgedrukt in kubieke meter of in een afgeleide eenheid. De temperatuur moet worden uitgedrukt in absolute temperatuur of Kelvin -temperatuur.
Dus als de temperaturen van een gas tot expressie worden gebracht in de schaal van Celsius of Celsius, moet de hoeveelheid 273,15 ºC worden toegevoegd aan temperaturen, om ze naar absolute temperaturen of kelvin uit te voeren om een berekening uit te voeren, om ze naar absolute temperaturen of kelvin te brengen,.
Als de temperaturen worden uitgedrukt in graden Farenheit, moet deze worden toegevoegd aan die temperaturen 459.67 ºR, om ze tot absolute temperaturen op de Rankine -schaal te brengen.
Een andere bekende formule van de wet van Charles, en direct gerelateerd aan zijn verklaring, is als volgt:
VT = Vof (1 + t/273)
Waar vT Het is het volume bezet door een gas op een bepaalde temperatuur, uitgedrukt in liters, cm3, enz.; en vof Het is het volume bezet door een gas bij 0 ºC. Van zijn deel is t de temperatuur waarbij de volumemeting wordt uitgevoerd, uitgedrukt in Celsius (ºC) graden (ºC).
En ten slotte vertegenwoordigt 273 de absolute nulwaarde op de Kelvin -temperatuurschaal.
Experimenteer om de wet aan te tonen
Montage
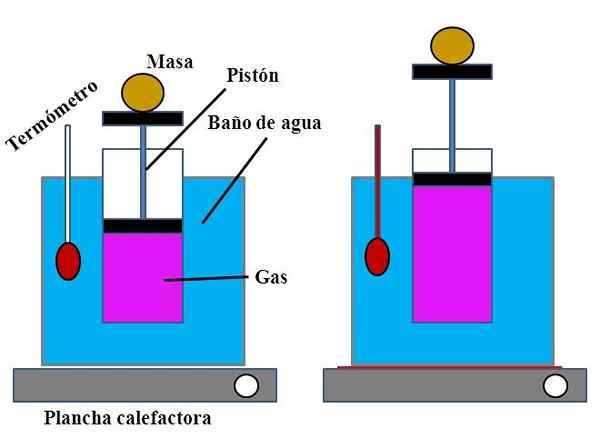 Vergadering van het experiment om de wet van Charles aan te tonen. Bron: Gabriel Bolívar.
Vergadering van het experiment om de wet van Charles aan te tonen. Bron: Gabriel Bolívar. In een watercontainer, die de functie van een waterbad vervulde, werd een open cilinder geplaatst door het bovenste gedeelte, met een plunjer die zich aangepast aan de binnenwand van de cilinder (superieur beeld).
Deze plunjer (gevormd door de zuiger en de twee zwarte basen) kan naar het bovenste of onderste deel van de cilinder gaan, afhankelijk van het volume gas dat het bevatte.
Het waterbad kan worden verwarmd door een lichtere of verwarmingsinstallatie te gebruiken, die de warmte leverde die nodig is om de badkamertemperatuur te verhogen en daarom de temperatuur van de cilinder uitgerust met een plunjer.
Kan u van dienst zijn: calciumhydroxide (ca (oh) 2): structuur, eigenschappen, verkrijgen, gebruikOp de plunjer werd een bepaalde massa geplaatst om ervoor te zorgen dat het experiment bij constante druk werd uitgevoerd. De badkamer en de cilindertemperatuur werd gemeten met behulp van een thermometer geplaatst in het waterbad.
Hoewel de cilinder waarschijnlijk geen afstuderen had om het volume van de lucht te visualiseren, kan dit worden geschat door de hoogte te meten die de massa op de plunjer en het oppervlak van de cilinderbasis heeft geplaatst.
Ontwikkeling
Het volume van een cilinder wordt verkregen door het oppervlak van zijn basis te vermenigvuldigen met zijn hoogte. Het oppervlak van de cilinderbasis kan worden verkregen door de formule toe te passen: s = pi x r2.
Terwijl de hoogte wordt verkregen door de afstand tot de basis van de cilinder te meten, tot de zuiger waarop het deeg rust.
Naarmate de badkamertemperatuur toeneemt door warmte geproduceerd door de aansteker, werd waargenomen dat de plunjer in de cilinder opkwam. Vervolgens lezen ze de temperatuur in het waterbad in de thermometer, die overeenkwam met het interieur van de cilinder.
Ze meten ook de hoogte van het deeg op de plunjer en kunnen het volume van lucht dat overeenkwam met de gemeten temperatuur schatten. Op deze manier hebben ze verschillende temperatuurmetingen en schattingen gemaakt van het luchtvolume dat overeenkomt met elk van de temperaturen.
Dit zou uiteindelijk kunnen vaststellen dat het volume dat door een gas wordt bezet, recht evenredig is met de temperatuur. Deze conclusie mocht de So -called Charles Law vermelden.
Globo met ijs in de winter
Naast het vorige experiment is er een eenvoudiger en meer kwalitatieve: die van de ballon met ijs in de winter.
Als in de winter een ballon vol helium in een kamer met verwarming werd geplaatst, zou de bol een bepaald volume hebben; Maar als het dan naar de buitenkant van het huis wordt verplaatst met een lage temperatuur, zou worden opgemerkt dat de heliumballon krimpt, waardoor het volume is verminderd volgens de wet van Charles.
Opgeloste oefeningen
Oefening 1
Je hebt een gas dat een volume van 750 cm bezet3 Bij 25 ºC: wat zal het volume zijn dat dit gas bezet bij 37 ºC als de constante druk wordt gehandhaafd?
Het is noodzakelijk om eerst de temperatuureenheden te transformeren naar Kelvin:
T1 In graden Kelvin = 25 ºC + 273.15 ºC = 298.15 K
T2 In graden kelvin = 37 ºC + 273.15 ºC = 310,15 k
Omdat het bekend is V1 en de andere variabelen, het wist V2 En het wordt berekend met de volgende vergelijking:
V2 = V1 · (T2 / T1))
= 750 cm3 · (310.15 K / 298.15 K)
= 780,86 cm3
Oefening 2
Wat zou de temperatuur zijn in graden Celsius waartoe 3 liter een gas moet worden verwarmd tot 32 ° C, zodat het volume uitzet tot 3,2 liter?
Nogmaals, de Celsius -graden in Kelvin worden getransformeerd:
T1 = 32 ºC + 273.15 ºC = 305.15 K
En zoals in de vorige oefening, wordt t gewist2 In plaats van V2, en berekent dan:
T2 = V2 · (T1 / V1))
= 3,2 L · (305.15 k / 3 l)
= 325.49 K
Maar de verklaring vraagt om graden Celsius, dus de eenheid van t is gewijzigd2:
T2 In graden Celsius = 325, 49 º C (k) - 273.15 ºC (k)
Kan u van dienst zijn: Pascal Syringe= 52.34 ºC
Oefening 3
Als een gas bij 0 ºC een volume van 50 cm bezet3, Welk volume zal het bezetten bij 45 ºC?
Met behulp van de oorspronkelijke formule van de wet van Charles:
VT = Vof (1 + t /273)
Ga verder met het berekenen van VT Direct wanneer u alle variabelen weggooit:
VT = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (K))
= 58,24 cm3
Aan de andere kant, als het probleem wordt opgelost met behulp van de strategie van voorbeelden 1 en 2, zullen we hebben:
V2 = V1 · (T2 / T1))
= 318 K · (50 cm3 / 273 K)
= 58,24 cm3
Het resultaat, het toepassen van de twee procedures, is hetzelfde omdat ze uiteindelijk gebaseerd zijn op hetzelfde principe van Charles Law.
Toepassingen
Wishe Galls
De ballonnen van wensen (al vermeld in de inleiding) zijn uitgerust met een textielmateriaal geïmpregneerd met een brandbare vloeistof.
Wanneer brand dit materiaal afvuurt, is er een toename van de luchttemperatuur in de wereld, wat een toename van het gasvolume veroorzaakt volgens de wet van Charles.
Daarom, door het volume van de lucht in de wereld te vergroten, neemt de dichtheid van de lucht erin af, die minder wordt gemaakt dan de dichtheid van de omringende lucht, en daarom stijgt de wereldbol op.
Pop-up thermometers of kalkoenen
Zoals aangegeven met de naam worden ze gebruikt tijdens het koken van kalkoenen. De thermometer heeft een container vol gesloten lucht met een deksel en wordt zodanig gekalibreerd dat bij het bereiken van de optimale kooktemperatuur het deksel wordt opgeheven door een geluid uit te zenden.
De thermometer wordt in de kalkoen geplaatst en naarmate de temperatuur in de oven stijgt, is de lucht in de thermometer uitgezet, waardoor de volume wordt verhoogd. Dus wanneer het luchtvolume een bepaalde waarde bereikt, maakt het de thermometerliftlift.
Herstel van de vorm van ping-pong ballen
Ping-pong ballen, afhankelijk van de vereisten van het gebruik ervan, zijn van een licht gewicht en hun kunststoffenwanden zijn weinig dik. Hierdoor worden ze beïnvloed door de rackets die worden vervormd.
Door de vervormde ballen in heet water te plaatsen, wordt de lucht erin verwarmd en treedt de expansie op, wat leidt tot een toename van het luchtvolume. Dit veroorzaakt ook een stuk van de muur van de ping-pong ballen, waardoor de oorspronkelijke vorm wordt hersteld.
Uitwerking van de Paes
Gisten worden opgenomen in tarwebloem die wordt gebruikt om brood te maken en hebben de mogelijkheid om koolstofdioxidegas te produceren.
Door de temperatuur van het brood tijdens het koken te verhogen, neemt het volume van koolstofdioxide toe. Hierdoor vindt er een uitbreiding van het brood plaats totdat het gewenste volume is bereikt.
Referenties
- Clark J. (2013). OTER GAS LACHTEN - De wet van Boyle en de wet van Charles. Hersteld van: chemguide.co.Uk
- Staroscik Andrew. (2018). Charles 'wet. Opgehaald uit: Scienteprimer.com
- Wikipedia. (2019). Charles Law. Opgehaald uit: in.Wikipedia.borg
- Helmestine, Todd. (27 december 2018). Wat is de formule voor de wet van Charles? Hersteld van: Thoughtco.com
- Profit. N. Leeuw. (S.F.)). Elementaire gaswetten: Charles Law. C 101 Klasse opmerkingen. Hersteld van: iun.Edu
- Briceño Gabriela. (2018). Charles Law. Hersteld van: Euston96.com
- Morris, J. G. (1974). Fysicochemie voor biologen. (2geeft editie). Redactionele terugvordering, s.NAAR.
- « Veertien punten van Wilson -achtergrond en hoe het Duitsland beïnvloedde
- Toepassingen van de concepten energie, kracht, kracht, werk »

