Ionisatie in fysica en chemieconcept, proces en voorbeelden

- 3751
- 896
- Lonnie Rohan
De ionisatie Het is al dat proces waarin elektrische belastingen worden gegenereerd uit neutrale deeltjes. Dit kan plaatsvinden via verschillende natuurlijke mechanismen of krachten, hetzij door straling, warmte, elektrische velden, magnetische velden of chemische reacties. Ionen worden als gevolg geproduceerd, die positief of negatief geladen atomen zijn.
Ionisatie is een fundamenteel proces voor symfines van fysische, chemische of natuurlijke fenomenen, waarbij de laatste vaak een mengsel van fysicochemische veranderingen is. Bij fysieke ionisaties komen bijvoorbeeld in principe chemische reacties niet op; Dat wil zeggen, ionenproductie impliceert niet de afbraak of vorming van nieuwe links.
 Veel natuurlijke fenomenen, zoals noorderlicht, zijn gebaseerd op de ionisatie van atmosfeermoleculen. Bron: Pixabay.
Veel natuurlijke fenomenen, zoals noorderlicht, zijn gebaseerd op de ionisatie van atmosfeermoleculen. Bron: Pixabay. In natuurlijke fenomenen gaat deze ionisatie echter meestal gepaard met chemische reacties, zoals de vorming van ozon op lage hoogten. Ook worden tijdens de onweersbuien stikstofoxiden gegenereerd vanwege de stralen en hun intense temperaturen, die de stikstof van de lucht oxideren.
Aan de andere kant kan de ionisatie sluipen: binnen hetzelfde water, in het wrijven tussen twee oppervlakken, in de oxidaties van de metalen of bij het oplossen van bepaalde gassen in water.
[TOC]
Chemie ionisatie
Oxidatie-reductie
 Tijdens de werking van de batterijen van speelgoed, zijn ionen en elektronen voortdurend. Bron: D J Shin/CC BY-SA (https: // CreativeCommons.Org/licenties/by-sa/3.0)
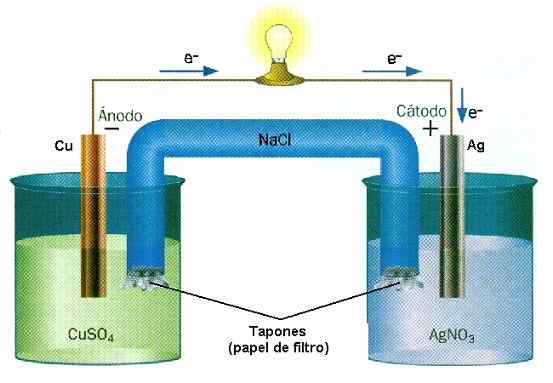
Tijdens de werking van de batterijen van speelgoed, zijn ionen en elektronen voortdurend. Bron: D J Shin/CC BY-SA (https: // CreativeCommons.Org/licenties/by-sa/3.0) Bij chemische ionisatie worden ionen geproduceerd door vorming te breken of te verbinden. Twee stoffen verdienen of verliezen elektronen onomkeerbaar: degene die de elektronen verliest, verwerft een positieve belasting, terwijl degene die wint een negatieve belasting behoudt.
 Voorbeeld van oxide-reactiereductie in Cu-AG-stapel. Bron: waterwand/cc by-sa (http: // creativeCommons.Org/licenties/by-sa/3.0/)
Voorbeeld van oxide-reactiereductie in Cu-AG-stapel. Bron: waterwand/cc by-sa (http: // creativeCommons.Org/licenties/by-sa/3.0/) In de batterijen verliest een stof elektronen terwijl een andere ze wint. Deze elektronen reizen en activeren de elektrische circuits van een apparatuur, om uiteindelijk terug te keren naar een tweede paalcompartiment, waar de andere stof hen wacht om ze te vangen en negatief te laden. Dit is een voorbeeld van een chemische ionisatie die wordt uitgevoerd door een oxide-reductiereactie.
Kan u dienen: gluconzuur: structuur, eigenschappen, synthese, gebruikHeterolytische breuk
Een ander type chemische ionisatie is te wijten aan heterolithische breuk. Wanneer deze pauze optreedt, wordt de A-B-link verbroken om de ionen te vormen+ en B-, Omdat de elektronen zijn gericht op het atoom waarvoor ze "meer affiniteit voelen". Heterolithische breuk is meestal de eerste stap die de mechanismen van veel organische reacties regelt.
Selfionisatie
Elektrische belastingen kunnen op zichzelf niet alleen verschijnen door de elektronenbeweging, maar ook door de links die worden verbroken of vormen in een uitwisseling van atomen. Dit is het geval van zelfisatie, wat gebeurt tussen twee moleculen van dezelfde verbinding.
Van alle chemische ionisaties is zelf -ionisatie de eenvoudigste en meest onmerkbare, omdat het niet de mogelijkheid heeft om op zichzelf elektrische stroom te leiden.
Ionisatie in natuurkunde
Statische elektriciteit
 Het haar van dit meisje laadt positief op en steert elkaar af vanwege statische elektriciteit. Bron: BiseUp Ganguly/CC door (https: // creativeCommons.Org/licenties/door/3.0)
Het haar van dit meisje laadt positief op en steert elkaar af vanwege statische elektriciteit. Bron: BiseUp Ganguly/CC door (https: // creativeCommons.Org/licenties/door/3.0) Ionisatie heeft ook veel deelname aan fysieke fenomenen. Over het algemeen impliceert fysica -ionisatie geen chemische reacties. De atomen van materie worden elektrisch geladen zonder hun oorspronkelijke identiteit te verliezen.
Oppervlakken kunnen elektronen uitwisselen wanneer ze wrijven als een van hen effectiever is in het opslaan van ze, wat leidt tot statische elektriciteit. Er is niet langer gesproken over atomen, maar van een heel materiaal dat een negatieve of positieve belasting verwerft, en dat wanneer de balans wordt hersteld, een elektrische schok letterlijk tussen twee materialen of lichamen kan genereren.
Gasvormige ionisatie
Gedispergeerde gasvormige atomen kunnen elektronen verliezen als ze worden onderworpen aan een elektrisch veld. Daarbij zijn atomen opgewonden en losgelaten elektronen. Dan, bij het afkoelen en terugkeren naar hun status als een kleine energie, zeggen fotonen afscheid. En het proces wordt keer op keer herhaald. Het resultaat: een bron van verlichting of elektriciteit.
Kan u van dienst zijn: booroxide (B2O3): wat is, structuur, eigenschappen, gebruikStraling of botsingen ionisatie
Evenzo kan materie energie verkrijgen die wordt geboden door verschillende soorten straling (gamma, x -rees, ultraviolet, enz.) of door te botsen met hoge energie -deeltjes (ALFAS, bèta's en neutronen).
De bijgedragen energie is zodanig dat een elektron van het atoom direct is. Dit type ionisatie is gerelateerd aan meerdere radioactieve en kosmische fenomenen.
Waterionisatie
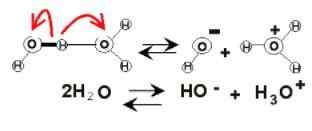 Waterdissociatie
Waterdissociatie In de boezem van water kunnen elektrische ladingen verschijnen vanwege zijn ionisatie. Dit is van de chemische stof, omdat twee watermoleculen plotseling op elkaar reageren om de H -ionen te dissociëren en te genereren3OF+ en oh-:
2h2Of (l) ⇌ h3OF+(AC) + OH-(AC)
Deze balans is erg ontheemd naar het water, dus er is nauwelijks een verachtelijke hoeveelheid van deze ionen.
Luchtionering
Luchtmoleculen nemen niet deel aan enig evenwicht van self -quilibrium. Zuurstof, stikstof, argon, waterdamp en de andere gassen die de lucht vormen, wisselen geen atomen of elektronen uit. Daarom is lucht geen goede elektriciteitsgeleider onder normale omstandigheden.
Als het echter wordt onderworpen aan een elektrisch veld, straling of intense temperaturen, kan het ion zijn en een goede bestuurder worden. Dit is wat er gebeurt, bijvoorbeeld wanneer elektrische stralen van wolken naar aarde vallen, elektronen door de lucht reizen met plotselinge lichtexplosie.
Ionisatievoorbeelden
Gedurende de vorige paragrafen zijn sommige ionisatievoorbeelden aangesteld. Ten slotte zullen enkele anderen worden genoemd.
Metaaloxidatie
Wanneer metalen oxideren, hetzij door de werking van de aarde zuurstof of door de aanval van zure stoffen, verwerven ze positieve ladingen om respectievelijk oxiden of zouten te vormen.
Kan u van dienst zijn: chemisch proces: principes, typen, voorbeeldenIJzer is bijvoorbeeld geïoniseerd dankzij zuurstof om te transformeren in geloofsionen3+, Gelegen in ijzeroxidenkristallen. Magnesium daarentegen lost op in zwavelzuur om elektronen te verliezen en als mg -ionen te blijven2+ In magnesiumsulfaatzout.
Gase -oplossing in water
Sommige gassen, zoals ammoniak en waterstofchloride, lossen op in water om hun neutraliteit te verliezen en aanleiding te geven tot ionenvorming. Ammoniak bijvoorbeeld wanneer het oplost, geeft NH -ionen gedeeltelijk los4+ en oh-. Ondertussen zal waterstofchloride bij het oplossen H -ionen produceren3OF+ en Cl- volledig.
Een soortgelijk geval is het oplossen van zouten in water, zoals magnesiumsulfaat, MGSO4. MG -ionen2+ En dus42- Ze zijn al aanwezig bij de zoutkristallen voordat ze in het water oplossen.
Verlichtingslampen of buizen

In stoomlampen of lichtbuizen zijn gasvormige atomen met elektrische schokken opgewonden om een bepaalde hoeveelheid licht en kleuren te produceren. Deze ionisatie vindt bijvoorbeeld plaats in natrium- of kwiklampen, evenals in de beroemde neonlichten met hun heldere kleuren in restaurant of winkelinvoer.
Ionisatie -energieën
Ionisatie -energie, een periodieke eigenschap, wordt bestudeerd om chemische elementen te karakteriseren volgens het gemak waarmee hun gasvormige atomen hun elektronen doneren om positief te laden. Dus bijvoorbeeld hebben metalen meestal de laagste ionisatie -energieën, terwijl niet -metalen elementen en edelgassen, de hoogste.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Serway, r., Jewett, J. (2008). Natuurkunde voor wetenschap en engineering. Deel 1. 7e. Editie. Mexico. Cengage Learning Editors.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Ionisatie. Opgehaald uit: in.Wikipedia.borg
- De redacteuren van Enyclopaedia Britannica. (17 oktober 2016). Ionisatie. Encyclopædia Britannica. Hersteld van: Britannica.com
- Doug Stewart. (2018). Definitie van ionisatie: wat is ionisatie? Hersteld van: chemicool.com
- John Zavisa. (1 april 2020). Hoe bliksem werkt. Hersteld van: Wetenschap.Howstuffwork.com
- « 18 soorten gedrag en hun kenmerken (met voorbeelden)
- Gele liberalisme oorsprong, kenmerken, oorzaken, gevolgen »

