Chroomhydroxidestructuur, eigenschappen, synthese, gebruik
- 3453
- 767
- Aaron Okuneva
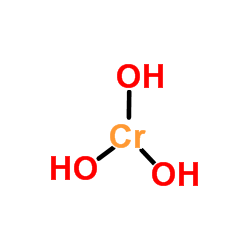
Hij Chroomhydroxide Het is een anorganisch samengesteld product van de reactie van een basis met een chroomzout. De chemische formule varieert volgens de chroomoxidatiestatus (+2 of +3, voor dit type verbinding). Dus Cr (OH)2 Voor chroomhydroxide (II) en Cr (OH)3 Voor chroomhydroxide (III).
Om elektronische redenen, de CR2+ is onstabieler dan de CR3+, Dus Cr (OH)2 Het is een reductiemiddel (verliest een elektron om naar +3 te gaan). Dus, hoewel beide hydroxiden kunnen worden verkregen als neerslag, de Cr (OH)3 -ook wel chromische hydroxide genoemd- is de overheersende verbinding.
 Chroom hydroxide uiterlijk
Chroom hydroxide uiterlijk In tegenstelling tot die hydroxiden verkregen door de eenvoudige oplossing van metaaloxiden in water, Cr (OH)3 Het wordt niet gesynthetiseerd door deze route vanwege de slechte oplosbaarheid van chroomoxide (CR2OF3, bovenste afbeelding). Echter Cr (OH)3 Het wordt beschouwd als de CR2OF3· XH2Of, gebruikt als smaragdgroen pigment (Guinet Green).
In het laboratorium is het gebaseerd op het metalen chroom, dat wordt opgelost in zure oplossing voor de vorming van het complex [Cr (OH2))6]3+. Dit waterige complex reageert vervolgens met een basis (NaOH of KOH) om de overeenkomstige chromische hydroxide te vormen.
Als de vorige stappen worden uitgevoerd onder omstandigheden die zorgen voor de afwezigheid van zuurstof, ontstaat de reactie Cr (OH)2 (Chrome hydroxide). Vervolgens is een scheiding en uitdroging van de neerslag vaste stof vereist. Als gevolg hiervan is de ware Cr (OH) "geboren"3, Een groen poeder met een polymere en onzekere structuur.
[TOC]
Chroomhydroxidestructuur
De bovenste afbeelding is de eenvoudigste weergave van Cr (OH)3 in gas en geïsoleerde fase. Ook en aannemen van het puur ionische karakter van zijn interacties, kan in de vaste kationen worden gevisualiseerd3+ Interactie met een drievoudige hoeveelheid oh anionen-.
Kan je van dienst zijn: molair absorberenDe aard van de CR-OH-link is echter meer covalent, vanwege CR-coördinatiechemie3+.
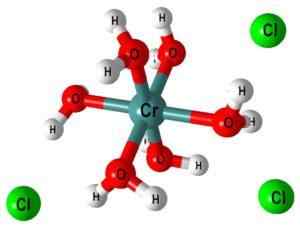
Bijvoorbeeld het complexe [Cr (OH2))6]3+ Het geeft aan dat het metalen chroomcentrum wordt gecoördineerd met zes watermoleculen; Omdat deze neutraal zijn, vertoont het complex de positieve belasting van het oorspronkelijke kation, Cr3+.
Octaëder en polymerisatie
In het bovenste beeld is de structuur van het complex [Cr (OH weergegeven2))6]3+. Clionen- Ze kunnen bijvoorbeeld komen uit zoutzuur in het geval dat het is gebruikt voor het oplossen van zout of chroomoxide.
Wanneer NaOH (of KOH) wordt toegevoegd aan het reactiemedium, het OH -ion- Uns een molecuul van dit complex, vormt [Cr (OH2))5(Oh)]2+ (Nu zijn er vijf watermoleculen omdat de zesde een proton verloor).
Opeenvolgend, dit nieuwe dehydraatcomplex voor een ander waterig complex, waardoor Dímeros United wordt gecreëerd door hydroxidebruggen:
(H2OF)5Cr-OH-CR (OH2))5
Naarmate de basiciteit van het medium toeneemt (stijgt de pH) het complex [Cr (OH2))4(OH)2]+, en vergroot ook de kansen van nieuwe hydroxidebruggen om jelly -polymeren te creëren. In feite weigert deze "grijs -groene gelei" ordelijk neer te slaan.
Eindelijk, Cr (oh2))3(OH)3 Het bestaat uit een octaëder met de CR3+ In het midden, en gekoppeld aan drie watermoleculen en drie OH- die hun positieve lading neutraliseren; Dit zonder polymerisatie te overwegen.
Wanneer de Cr (oh2))3(OH)3 Het is uitgedroogd, het gecoördineerde water met de Cr wordt geëlimineerd3+, En omdat dit kation wordt gecoördineerd met zes soorten (liganden), ontstaan polymere structuren waarbij CR-CR-verbindingen betrokken zijn.
Kan u van dienst zijn: Butyric Fat: verkrijgen, typen, samenstelling, gebruik, voordelenOok, wanneer uitgedroogd, kan de structuur ervan worden beschouwd als een CR -type2OF3· 3H2OF; Met andere woorden, die van tri-gehydrateerd chroomoxide. Het zijn echter de fysicochemische studies van de vaste stof die licht kunnen werpen op de ware structuur van Cr (OH)3 op dit punt.
Fysische en chemische eigenschappen van chroomhydroxide
Cr (OH)3 Het ziet eruit als een blauwgroen poeder, maar als het in contact komt met water, vormt het een grijsachtige groene gelei.
Het is onoplosbaar in het water, maar oplosbaar in zuren en sterke basen. Bovendien, wanneer het wordt verwarmd, breekt het af, waardoor chroomoxidedampen produceren.
Anfoterisme
Waarom is chroomhydroxide oplosbaar in zure en basisoplossingen? De reden is te wijten aan het amfoter -personage, waardoor u kunt reageren met zowel zuren als basen. Deze eigenschap is kenmerkend voor CR3+.
Bij het reageren met zuren, Cr (OH2))3(OH)3 Het wordt opgelost omdat de hydroxylbruggen zijn gebroken, verantwoordelijk voor de jellywoman van het neerslag.
Aan de andere kant, wanneer meer basis wordt toegevoegd, oh- Ze blijven de watermoleculen vervangen en vormen het negatieve complex [Cr (OH2))2(OH)4]-. Dit complex draait de oplossing van een lichtgroene kleur, die intensiveert naarmate de reactie doorgaat.
Wanneer alle Cr (oh2))3(OH)3 U hebt gereageerd, een laatste complex wordt verkregen zoals aangegeven door de chemische vergelijking:
Cr (oh2))3(OH)3 + 3 oh- [Cr (OH)6] 3- + 3 H2OF
Dit negatieve complex wordt geassocieerd met omliggende kationen (NA+, Als de basis NaOH is) en na de verdamping van water, het natriumchromito -zout (Nacro2, smaragdgroene kleur). Aldus kunnen zowel het zuur als het basismedium chroomhydroxide oplossen.
Kan u van dienst zijn: IndianSynthese van chroomhydroxide op industrieel veld
In de industrie wordt het geproduceerd door chroomsulfaatprecipitatie met natrium- of hydroxide -hydroxide -oplossingen. Evenzo wordt chroomhydroxide geproduceerd door een gesprekkende reactie:
Cro72- + 3 Dus2 + 2h+ => 2 cr3+ + 3 Dus42- + H2OF
Cr3+ + 3oH- => Cr (oh)3
Zoals getoond in de vorige procedure, heeft Chrome Reduction VI tot Chrome III een groot ecologisch belang.
Chroom III is relatief onschadelijk voor Biota, terwijl chroom VI giftig en carcinogeen is, naast zeer oplosbaar, dus de eliminatie van het milieu is van belang.
Water- en bodembehandelingstechnologie omvat een reductie van Cr (VI) naar Cr (III).
Toepassingen
Chroomhydroxide heeft verschillende toepassingen:
- Make -upformulering.
- Haar kleuren.
- Nagellak.
- Huidverzorgingsproducten.
- Schoonmaakproducten.
- In de metalen afwerking, die 73 % van zijn consumptie in de industrie vertegenwoordigt.
- In het behoud van hout.
Referenties
- Whitten, Davis, Peck & Stanley. Scheikunde. (8e ed.)). Cengage Learning, p 873, 874.
- Pubchem. Chromische hydroxide. Hersteld van PubChem.NCBI.NLM.NIH.Gov
- Synthese, karakterisering en stabiliteit van Cr (III) en Fe (III) hydroxiden. Papassiopi, n., Vaxevanidou, k., Christou, c., Karagianni, E. en Antipas, G. J. Gevaar mater. 264: 490-497.
- Prebchem. Bereiding van chroom (III) hydroxide. Hersteld van prapchem.com
- Wikipedia. (2018). Chroom (III) hydroxide. Opgehaald van.Wikipedia.borg