Waterstofgeschiedenis, structuur, eigenschappen en gebruik

- 924
- 218
- James Dach
Hij waterstof Het is een chemisch element dat wordt weergegeven door symbool h. Zijn atoom is de kleinste van allemaal en het is waarmee het periodiek systeem begint, ongeacht waar hij is gepositioneerd. Het bestaat uit een kleurloos gas bestaande uit diatomaire moleculen van h2, en niet voor geïsoleerde atomen van H; Net als bij de edelgassen hij, ne, ar, onder anderen.
Van alle elementen is het misschien wel de meest emblematische en gemarkeerde, niet alleen vanwege zijn eigenschappen in terrestrische of drastische omstandigheden, maar vanwege zijn immense overvloed en variëteit van zijn verbindingen. Waterstof is een gas, hoewel inert in afwezigheid van vuur, brandbaar en gevaarlijk; Terwijl water, h2Of het is het universele oplosmiddel en het leven.
 Rode cilinders die worden gebruikt om waterstof op te slaan. Bron: Famartin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Rode cilinders die worden gebruikt om waterstof op te slaan. Bron: Famartin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Op zichzelf vertoont waterstof geen visuele eigenaardigheid die het bewonderen waard is, gewoon een gas zijn dat wordt opgeslagen in rode cilinders of hubs. Ze zijn echter de eigenschappen en het vermogen om te linken naar alle elementen, die terugkeren naar speciale waterstof. En dit alles, hoewel het alleen een elektron uit Valencia heeft.
Als de waterstof niet in hun respectieve cilinders wordt opgeslagen, zou deze ontsnappen aan de ruimte terwijl een groot deel reageert in de beklimming. En zelfs als het een zeer lage concentratie in de lucht heeft die we inademen, buiten de aarde en in de rest van het universum, is het het meest voorkomende element, in de sterren zijn en zijn constructie -eenheid beschouwd.
Aan de andere kant, aan de andere kant, vertegenwoordigt het ongeveer 10% van zijn totale massa. Om te visualiseren wat dit betekent, moet worden geacht dat het oppervlak van de planeet praktisch bedekt is met oceanen en dat waterstof wordt gevonden in mineralen, in olieolie en in elke organische verbinding, naast het maken van alle levende wezens.
Net als koolstof, alle biomoleculen (koolhydraten, eiwitten, enzymen, DNA, etc.) Ze hebben waterstofatomen. Daarom zijn er veel bronnen om het te extraheren of te produceren; Weinigen vertegenwoordigen echter echt winstgevende productiemethoden.
[TOC]
Geschiedenis
Identificatie en naam
Hoewel in 1671 Robert Boyle voor het eerst een gas zag dat werd gevormd toen ijzerbestanden reageerden met zuren, was de Britse wetenschapper Henry Cavendish, in 1766, die hem identificeerde als een nieuwe stof; De "brandbare lucht".
Cavendish ontdekte dat toen deze vermeende brandbare lucht verbrandde, water werd gegenereerd. Op basis van zijn werk en resultaten gaf de Franse chemicus Antoine Lavoisier dit gas de naam van waterstof in 1783. Etymologisch is de betekenis ervan afgeleid van de Griekse woorden 'hydro' en 'genen': waterformator.
Elektrolyse en brandstof
Kort daarna ontdekten Amerikaanse wetenschappers William Nicholson en Sir Anthony Carlisle in 1800 dat water kan ontleden in waterstof en zuurstof; had waterelektrolyse gevonden. Vervolgens, e 1838, introduceerde de Zwitserse chemicus Christian Friedrich Schoenbein het idee om gebruik te maken van waterstofverbranding om elektriciteit te genereren.
De populariteit van waterstof was zozeer dat zelfs de schrijver Julio Verne het in zijn boek een brandstof van de toekomst noemde Het mysterieuze eiland (1874).
Isolatie
In 1899 was de Schotse chemicus James Dewar de eerste die waterstof isoleert als vloeibaar gas, zichzelf die het genoeg kon koelen om het in zijn vaste fase te verkrijgen.
Twee kanalen
Vanaf dit punt presenteert de geschiedenis van waterstof twee kanalen. Enerzijds zijn de ontwikkeling ervan op het gebied van brandstoffen en batterijen; En aan de andere kant, het begrip van de structuur van zijn atoom en hoe hij het element vertegenwoordigde dat de deuren opende voor de kwantumfysica.
Elektronische structuur en configuratie
 Diatomee waterstofmolecuul. Bron: Benjah-bmm27 [Public Domain]
Diatomee waterstofmolecuul. Bron: Benjah-bmm27 [Public Domain] Waterstofatomen zijn erg klein en hebben nauwelijks een elektron om covalente bindingen te vormen. Wanneer twee van deze atomen samenkomen, geven ze aanleiding tot een diatomisch molecuul, h2; Dit is gasmoleculaire waterstof (superieur beeld). Elke witte bol komt overeen met een individueel H -atoom en de globale bol met moleculaire orbitalen.
Aldus bestaat waterstof echt uit H -moleculen2 Zeer klein dat interageert via London Dispersion -troepen, omdat ze een dipoolmoment missen omdat ze homonucleair zijn. Daarom zijn ze erg "rusteloos" en verspreiden ze zich snel in de ruimte, omdat er geen sterke intermoleculaire krachten zijn om ze te vertragen.
De elektronische waterstofconfiguratie is gewoon 1s1. Dit orbitaal, 1S, is het product van de resolutie van de beroemde Schrödinger -vergelijking voor het hydrogenoidatoom. In h2 Twee 1s orbitalen overlappen zich om twee moleculaire orbitalen te vormen: een van link en een andere van antienlace, volgens de moleculaire orbitale theorie (Tom).
Deze orbitalen staan het bestaan van H -ionen toe of verklaren2+ of h2-; Waterstofchemie wordt echter onder normale omstandigheden gedefinieerd door h2 of de ionen h+ of h-.
Oxidatienummers
Van de elektronische configuratie voor waterstof, 1s1, Het is heel gemakkelijk om zijn mogelijke oxidatienummers te voorspellen; In gedachten zijn natuurlijk dat de orbitale 2's van grotere energie niet beschikbaar zijn voor chemische links. Aldus heeft de waterstof in basale toestand een oxidatienummer van 0, h0.
Het kan u van dienst zijn: nikkelhydroxide (ii): structuur, eigenschappen, gebruik, risico'sAls u uw enige elektron verliest, is de 1s orbital leeg en wordt het kation of waterstofion gevormd, h+, van grote mobiliteit in bijna elk vloeibaar medium; Vooral water. In dit geval is het oxidatienummer +1.
En voor wanneer het tegenovergestelde gebeurt, dat wil zeggen, het winnen van een elektron, zal het orbitaal nu twee elektronen hebben en zal ik 1s zijn2. Dan is het oxidatienummer -1 en komt overeen met het hydride -anion, h-. Het is vermeldenswaard dat h- Hij is isolectronisch tot nobel heliumgas, hij; dat wil zeggen, beide soorten hebben hetzelfde aantal elektronen.
Samenvattend zijn waterstofoxidatienummers: +1, 0 en -1 en het H -molecuul2 telt alsof ze twee waterstofatomen hadden h0.
Fasen
De favoriete fase van waterstof, althans in terrestrische omstandigheden, is frisdrank, vanwege de eerder vermelde redenen. Wanneer de temperatuur echter afneemt in de volgorde van -200 ºC, of als de druk honderdduizenden keren toeneemt dan atmosferisch, kan waterstof respectievelijk condenseren of kristalliseren in een vloeibare of vaste fase.
Onder deze omstandigheden h2 Ze kunnen aansluiten op verschillende manieren om structurele patronen te definiëren. London dispersiekrachten worden nu zeer directioneel en daarom verschijnen geometrieën of symmetrieën die door leeftijdsgenoten worden aangenomen,2.
Bijvoorbeeld twee HSSE's H2, Het is als schrijven (h2))2 Definieer een symmetrisch of asymmetrisch vierkant. Ondertussen, drie paren h2, of (h2))3 Ze definiëren een zeshoek, zeer vergelijkbaar met die van koolstof in grafietkristallen. In feite is deze zeshoekige fase de belangrijkste of meest stabiele voor vaste waterstof.
Maar wat als de vaste stof niet uit moleculen was samengesteld, maar van h? Dan zouden we met metaalwaterstof omgaan. Deze H -atomen, die de witte bollen onthouden, kunnen zowel een vloeibare fase als een metaalachtige vaste stof definiëren.
Eigenschappen
Fysiek uiterlijk
Waterstof is een kleurloos, reukloos en smakeloos gas. Daarom, als er een lek is, vertegenwoordigt een risico op explosie.
Kookpunt
-253 ºC.
Smeltpunt
-259 ºC.
Ontstekingspunt en stabiliteit
Praktisch explodeert het bij elke temperatuur als er een vonk of warmtebron dicht bij gas is, zelfs zonlicht kan waterstof afvuren. Zolang het maar goed is opgeslagen, is het een beetje reactief gas.
Dikte
0,082 g/l. Is 14 keer lichter dan lucht.
Oplosbaarheid
1,62 mg/l bij 21 ºC in water. Het is in het algemeen onoplosbaar in de meeste vloeistoffen.
Dampdruk
1.24 · 106 mmHg bij 25 ºC. Deze waarde geeft een idee van hoe gesloten de waterstofcilinders moeten zijn om te voorkomen dat gas ontsnapt.
Zelf -richtingtemperatuur
560VºC.
Elektronegativiteit
2.20 Op de Pauling -schaal.
Verbranding warmte
-285,8 kJ/mol.
Verdampingswarmte
0,90 kJ/mol.
Fusiewarmte
0,117 kJ/mol.
Isotopen
Het "normale" waterstofatoom is de protio, 1H, die ongeveer 99,985% van de waterstof vormt. De andere twee isotopen voor dit element zijn het deuterium, 2H, en het tritium, 3H. Deze verschillen in het aantal neutronen; Het deuterium heeft een neutron, terwijl de tritio er twee heeft.
Stekels isomeren
Er zijn twee soorten moleculaire waterstof, h2: Ortho en voor. In de eerste zijn de twee spins (van het proton) van de H -atomen op dezelfde richting georiënteerd (ze zijn parallel); Terwijl in het tweede de twee spins in tegengestelde richtingen zijn (ze zijn antiparallel).
Waterstof-voor is de meest stabiele van de twee isomeren; Maar door de temperatuur te verhogen, de ortho-relatie: 3: 1 worden, wat betekent dat het waterstoforgan-isomeer boven de andere overheerst. Bij zeer lage temperaturen (op afstand dicht bij absolute nul, 20K), pure waterstof-voor.
Nomenclatuur
De nomenclatuur om naar waterstof te verwijzen is een van de eenvoudigste; Hoewel het niet op dezelfde manier is voor hun anorganische of organische verbindingen. De H2 Het kan worden aangeroepen met de volgende namen naast 'waterstof':
-Moleculaire waterstof
-Dihydrogen
-Diatomee waterstofmolecuul.
Voor ion h+ Hun namen zijn proton- of waterstofion; En als het in waterig medium is, h3OF+, Hydroniumkation. Terwijl ion h- Het is het hydride -anion.
Het waterstofatoom
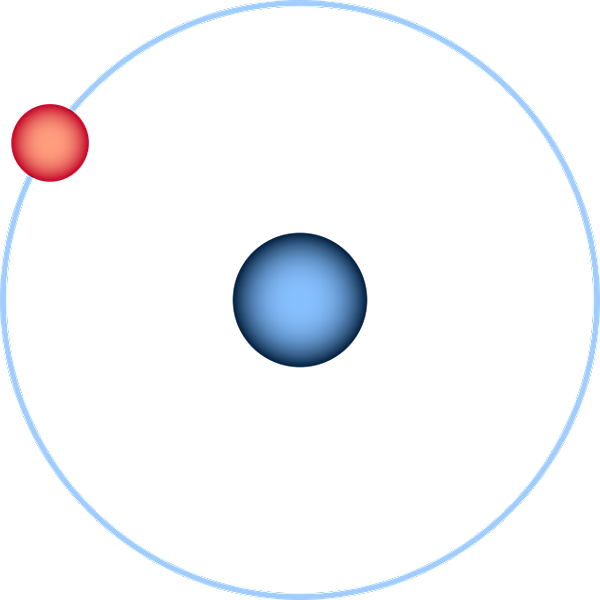 Het waterstofatoom vertegenwoordigd door het planetaire model van Bohr. Bron: Pixabay.
Het waterstofatoom vertegenwoordigd door het planetaire model van Bohr. Bron: Pixabay. Het waterstofatoom is het eenvoudigste van allemaal en wordt meestal weergegeven als in het superieure beeld: een kern met een eenzaam proton (voor de 1H), omgeven door een elektron dat een baan trekt. Op dit atoom zijn alle atomaire orbitalen voor de andere elementen van het periodiek systeem gebouwd en geschat.
Een meer loyale weergave aan het huidige begrip van atomen zou die van een bol zijn waarvan de periferie wordt bepaald door de elektronische en probabilistische wolk van het elektron (zijn 1s orbitaal).
Kan u van dienst zijn: thermisch: structuur, kenmerken, formatie, voorbeeldenWaar is en productie
 A Stars Field: onuitputtelijke bron van waterstof. Bron: Pixabay.
A Stars Field: onuitputtelijke bron van waterstof. Bron: Pixabay. Waterstof is, hoewel misschien in mindere mate in vergelijking met koolstof, het chemische element dat zonder twijfel kan worden gezegd dat overal is; In de lucht, naast het water dat de zeeën, oceanen en ons lichaam vult, in de olie -ruwe olie en mineralen, evenals in de organische verbindingen die zijn geassembleerd om het leven te ontstaan.
Het is voldoende om oppervlakkig naar elke samengestelde boekwinkel te kijken om waterstofatomen erin te vinden.
De vraag ligt niet zozeer hoeveel maar hoe het aanwezig is. Bijvoorbeeld het M -molecuul2 Het is zo vluchtig en reactief onder de incidentie van zonnestralen, wat zeer schaars is in de atmosfeer; Daarom reageert het om zich bij andere elementen aan te sluiten en dus stabiliteit te krijgen.
Hoewel hierboven, in de kosmos, is waterstof voornamelijk als neutrale atomen, h.
In feite wordt waterstof in zijn metaal- en gecondenseerde fase beschouwd, zoals de Star Construction Unit. Wanneer er onmetelijke hoeveelheden van hen zijn en vanwege hun robuustheid en kolossale dimensies, maken ze dit element het meest voorkomende van het hele universum. Naar schatting komt 75% van de bekende materie overeen met waterstofatomen.
Natuurlijk
Verzamel de atomen van losse hydrogenen in ruimte klinkt onveranderlijk en extraheren ze uit de periferie van de zon, of van de vage, onbereikbare. Op aarde, waar de omstandigheden dit element dwingen te bestaan als h2, Het kan optreden door natuurlijke of geologische processen.
Waterstof heeft bijvoorbeeld zijn eigen natuurlijke cyclus waarin bepaalde bacteriën, microben en algen het kunnen genereren door fotochemische reacties. De escalatie van natuurlijke processen en parallellen met deze omvat het gebruik van bioreactoren, waarbij bacteriën zich voeden met koolwaterstoffen om waterstof af te geven.
Levende wezens zijn ook waterstofproducenten, maar in mindere mate. Als dat zo is, zou niet kunnen worden uitgelegd hoe een van de gasvormige componenten van winderigheid vormt; die overdreven hebben aangetoond dat ze ontvlambaar zijn.
Ten slotte is het vermeldenswaard dat in anaërobe omstandigheden (zonder zuurstof), bijvoorbeeld in ondergrondse lagen, mineralen langzaam kunnen reageren met water om waterstof te produceren. Fayelita's reactie toont het aan:
3FE2SIO4 + 2 H2O → 2 geloof3OF4 + 3 SIO2 + 3 H2
Industrieel
Hoewel biohydrogen een alternatief is om dit gas op industriële schalen te genereren, zijn de meest gebruikte methoden praktisch "om waterstof te" wegnemen "naar de verbindingen die het bevatten, zodat hun atomen samenvoegen en de h vormen2.
De minste omgevingsmethoden om het te produceren bestaan uit het reageren van de cola (of houtskool) met oververhitte waterdamp:
C (s) + h2O (G) → Co (G) + H2(G)
Evenzo is aardgas voor dit doel gebruikt:
Ch4(g) + H2O (G) → Co (G) + 3H2(G)
En omdat de hoeveelheden cola of aardgas enorm zijn, is het winstgevend om waterstof te produceren door een van deze twee reacties.
Een andere methode om waterstof te verkrijgen is om een elektrische schok op het water aan te brengen om deze in zijn elementaire onderdelen te ontbinden (elektrolyse):
2 H2Of (l) → 2 h2(g) + of2(G)
Bij het laboratorium
In elk laboratorium kan moleculaire waterstof in kleine hoeveelheden worden bereid. Om dit te doen, moet een actief metaal worden gereageerd met een sterk zuur, hetzij in een beker of in een testbuis. De waarneembare bel is een duidelijk teken van waterstofvorming, weergegeven door de volgende algemene vergelijking:
M (s) + NH+(AC) → MN+(AC) + H2(G)
Waar n de metalen Valencia is. Dus bijvoorbeeld reageert magnesium met h+ Om h te produceren2:
Mg (s) + 2H+(AC) → Mg2+(AC) + H2(G)
Reacties
Rédox
Oxidatienummers bieden zelf een eerste benadering van hoe waterstof deelneemt aan chemische reacties. De H2 Bij het reageren kan het ongewijzigd blijven of op de H -ionen delen+ of h- Afhankelijk van welke soort het verbindt; Als ze min of meer elektronegatief zijn dan hij.
De H2 Het is weinig reactief vanwege de sterkte van zijn covalente binding, H-H; Dit is echter geen absolute belemmering om te reageren en verbindingen te vormen met bijna alle elementen van het periodiek systeem.
De bekendste reactie is met die van zuurstofgas om waterdampen te produceren:
H2(g) + of2(g) → 2H2O (g)
En het is zo'n affiniteit voor zuurstof om het stabiele watermolecuul te vormen, dat er zelfs mee kan reageren als anion of2- In bepaalde metaaloxiden:
H2(g) + cuo (s) → cu (s) + h2Of (l)
Ook reageert zilveroxide of "vermindert" met dezelfde reactie:
H2(g) + aug (s) → Ag (s) + h2Of (l)
Deze waterstofreacties komen overeen met die van het type Rédox. Dat wil zeggen reductie-oxidatie. Waterstof oxideert zowel in aanwezigheid van zuurstof- als metaaloxiden van minder reactieve metalen dan hij; Bijvoorbeeld koper, zilver, wolfraam, kwik en goud.
Absorptie
Sommige metalen kunnen gasvormige waterstof absorberen om metaalhydroren te vormen, die worden beschouwd alsof ze legeringen zijn. Overgangsmetalen zoals paladium absorberen bijvoorbeeld beruchte hoeveelheden h2, vergelijkbaar zijn met metalen sponzen.
Kan u van dienst zijn: neodymium: structuur, eigenschappen, gebruikHetzelfde gebeurt met meer complexe metaallegeringen. Op deze manier kan waterstof op andere manieren worden opgeslagen naast de cilinders.
Toevoeging
Organische moleculen kunnen ook waterstof "absorberen" door moleculaire mechanismen en/of verschillende interacties.
Voor metalen, H -moleculen2 Ze zijn omgeven door metalen atomen in hun kristallen; Terwijl in organische moleculen, wordt de H-H-binding verbroken om andere covalente bindingen te vormen. In een meer geformaliseerde zin: waterstof wordt niet geabsorbeerd, maar wordt aan de structuur toegevoegd.
Het klassieke voorbeeld is de toevoeging van h2 Om respectievelijk te verdubbelen of drievoudige link van alkenes of alkines:
C = C + H2 → H-C-C-C-H
C≡C + H2 → hc = ch
Deze reacties krijgen ook de naam van de hydrogenering.
Hydros -vorming
Waterstof reageert rechtstreeks op de elementen om een familie van chemische verbindingen te vormen die Hydros worden genoemd. Er zijn voornamelijk twee soorten: Salinos en Molecular.
Er zijn ook metaalhydroren, die bestaan uit de metaallegeringen die al worden genoemd wanneer deze metalen gasvormige waterstof absorberen; en het polymeer, met netwerken of ketens van e-H-bindingen, waar het het chemische element aangeeft.
Salinos
In zoutoplossinghydroren neemt waterstof deel aan de ionische binding zoals hydride -anion, h-. Om dit te vormen, moet het element noodzakelijkerwijs minder elektronegatief zijn; Anders zou het zijn elektronen niet opgeven aan waterstof.
Daarom worden zoutoplossinghydros alleen gevormd wanneer waterstof reageert met zeer elektropositieve metalen, zoals alkalische en alkaliners.
Waterstof reageert bijvoorbeeld met metalen natrium om natriumhydride te produceren:
2na (s) + h2(g) → 2nah (s)
Of met barium om bariumhydride te produceren:
Ba (s) + h2(g) → bah2(S)
Moleculair
Moleculaire hydriden zijn zelfs beter bekend dan ionisch. Ze ontvangen ook de naam van waterstofhalogenuros, HX, wanneer waterstof reageert met een halogeen:
Klet2(g) + H2(g) → 2HCl (g)
Hier neemt de waterstof deel aan de covalente binding als h+; Sindsdien is de verschillen tussen de elektronegativiteiten tussen beide atomen niet erg groot.
Hetzelfde water kan worden beschouwd als een zuurstofhydride (of waterstofoxide), waarvan de vormingsreactie al was blootgesteld. Zeer vergelijkbaar is de reactie met zwavel om waterstofsulfide te geven, een stinkend gas:
S (s) + h2(g) → h2S (g)
Maar van alle moleculaire hydroren is de meest beroemde (en misschien wel het moeilijkst te synthetiseren) ammoniak:
N2(g) + 3H2(g) → 2nh3(G)
Toepassingen
In de vorige sectie was een van de belangrijkste toepassingen van waterstof al aangepakt: als een grondstof voor de ontwikkeling van synthese, anorganisch of organisch. Het beheersen van dit gas heeft meestal een ander doel dan om het te laten reageren om andere verbindingen te maken die verschillen van die welke zijn geëxtraheerd.
Grondstof
- Het is een van de reagentia voor de synthese van ammoniak, die op zijn beurt eindeloze industriële toepassingen heeft, te beginnen met de uitwerking van meststoffen, totdat het materiaal voor stikstofarme geneesmiddelen.
- Het is bedoeld om te reageren met koolmonoxide en dus methanol te produceren, een reagens dat veel biobrandstoffen bevat.
Reduceren
- Het is een reductiemiddel van bepaalde metaaloxiden, dus het wordt gebruikt in metallurgische reductie (al uitgelegd in het geval van koper en andere metalen).
- Vers verminderen of oliën om margarine te produceren.
Olie industrie
In de olie -industrie wordt waterstof gebruikt om de olie -ruwe olie in verfijningsprocessen te "hydrotratar".
Het probeert bijvoorbeeld grote en zware moleculen in kleine moleculen en met een grotere vraag in de markt te fragmenteren (Hydrocracheus); vrijgave metalen gevangen in petroporfirinekooien (hydrodesmetalisatie); elimineer zwavelatomen als h2S (hydrodesulfurisatie); of dubbele links verminderen om rijke mengsels in paraffines te creëren.
Brandstof
Waterstof zelf is een uitstekende brandstof voor raketten of ruimtevaartuigen, omdat kleine hoeveelheden ervan reageren met zuurstof, ze geven enorme hoeveelheden warmte of energie af.
Op kleinere schaal wordt deze reactie gebruikt voor het ontwerp van cellen of waterstofbatterijen. Deze cellen worden echter geconfronteerd met de moeilijkheden om dit gas niet goed op te slaan; en de uitdaging om volledig onafhankelijk van het verbranden van fossiele brandstoffen.
Aan de positieve kant, gebruikt als brandstof, geeft waterstof alleen water af; In plaats van gassen die middelen voor vervuiling vertegenwoordigen voor de atmosfeer en ecosystemen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Hanyu Liu, Li Zhu, Wenwen Cui en Yanming MA. (S.F.)). Room-temperatuurstructuren van vaste waterstof bij hoge drukken. State Key Lab of Superhard Materials, Jilin University, Changchun 130012, China.
- Pierre-Marie Robitaille. (2011). Vloeibare metalen waterstof: een bouwsteen voor de vloeibare zon. Afdeling Radiologie, The Ohio State University, 395 W. 12th Ave, Columbus, Ohio 43210, VS.
- De Bodner -groep. (S.F.)). De chemie van waterstof. Opgehaald uit: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Waterstof. Opgehaald uit: in.Wikipedia.borg
- Waterstof Europa. (2017). Waterstoftoepassingen. Teruggewonnen uit: hydrogeneurope.EU
- Laura. (2019). Waterstof: eigenschappen en gebeurtenis. Studie. Hersteld van: studie.com
- Jonas James. (4 januari 2009). De geschiedenis van waterstof. Opgehaald uit: Altenergymag.com
- « Pichincha Battle Oorzaken, gevolgen en karakters
- Pastorale nieuwe kenmerken, vertegenwoordigers, werken »

