Hexano (C6H14) Fysische en chemische eigenschappen, structuur, gebruik, toxiciteit
- 4795
- 366
- Miss Herman Russel
Hij hexaan Het is een koolwaterstof die wordt gekenmerkt door een organische verbinding waarvan de gecondenseerde chemische formule C is6H14. Het is een kleurloze, transparante vloeistof, die niet met water kan worden gemengd. Het presenteert vijf isomeren, het lineaire is een van de belangrijkste paraffine koolwaterstoffen in de industrie en onderzoek.
Hexaan wordt verkregen door gefractioneerde destillatie van ruwe olie. Het is ook van nature aanwezig in citrusvruchten en vluchtige fracties van verschillende planten of fruit zoals appel, guave, geroosterde hazelnoten, zoete aardappel en salie.
 N-hexaanmolecuul. Bron: Benjah-bmm27 [Public Domain]
N-hexaanmolecuul. Bron: Benjah-bmm27 [Public Domain] Het is een zeer ontvlambare vluchtige vloeistof gevonden in benzine, snel drogende lijm en in wrijvende cement. Hexaan wordt gebruikt als een oplosmiddel in het extractieproces van plantaardige oliën, evenals lipiden en vetten die aanwezig zijn in besmet water en bodem.
Mensen die professioneel worden blootgesteld aan hexano, kunnen schade ondervinden aan het perifere zenuwstelsel, gemanifesteerd door tintelingen en benen in de benen en armen; Naast gegeneraliseerde gespierde zwakte en, in ernstige gevallen, atrofie van de skeletspieren.
[TOC]
Fysische en chemische eigenschappen van hexans
Fysiek uiterlijk
Kleurloos, transparant en zeer vluchtige vloeistof.
Molaire massa
86,178 g/mol
Geur
Benzine vergelijkbaar
Geurdrempel
1.5 ppm
Dikte
0,6606 g/ml
Smeltpunt
-96 tot -94 ºC
Kookpunt
68,5 tot 69,1 ºC
ontstekingspunt
-22 ºC (gesloten beker).
Oplosbaarheid in water
9,5 mg/l (praktisch niet -menigbaar met water)
Oplosbaarheid in oplosmiddelen
Zeer oplosbaar in ethanol, oplosbaar in ethylether en chloroform. Mengbaar met alcohol, chloroform en ether.
Relatieve stoomdichtheid met lucht
2.97 (lucht = 1)
Octanol/waterpartitiecoëfficiënt
Log p = 3,764
Dampdruk
17,60 kPa bij 20 ºC
Golflengte van maximale optische dichtheid
200 nm
Het kan u van dienst zijn: Niobio (NB): structuur, eigenschappen, gebruik, verkrijgenBrekingsindex
1.375
Smurrie
0,3 MPa · s
Calorische capaciteit
265.2 J · K-1· Mol-1
Verbranding warmte
4.163.2 kJ · mol-1
Verdampingswarmte
31.56 kJ · mol-1
Oppervlaktespanning
17,89 mn/m A 25 ºC
Ionisatiepotentieel
10,18 eV
Stabiliteit
Stal. Onverenigbaar met oxidatiemiddelen, chloor, fluoride, magnesiumperchloraat. Vormt een explosief mengsel met de lucht.
Reactiviteit
Hexaan kan krachtig reageren met oxiderende materialen, waaronder vloeibaar chloor, geconcentreerde zuurstof, natriumhypochloriet en calciumhypochloriet. Het is ook onverenigbaar met dyitrogen tetroxide. Hexane kan enkele vormen van kunststoffen, rubber en coatings aanvallen.
Hexaanstructuur
Intermoleculaire interacties
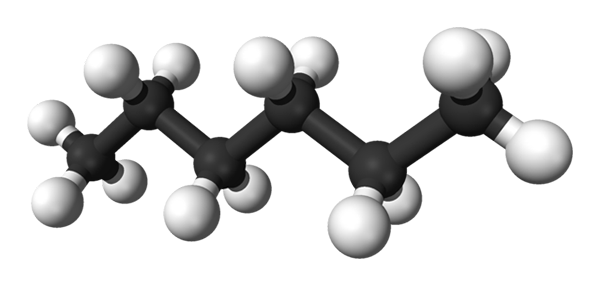
De eerste afbeelding toont het molecuul van de N-Hexaan vertegenwoordigd door een model van bollen en bars. De zwarte bollen komen overeen met koolstofatomen, samen met het zigzagging -koolstofskelet, terwijl de witte bollen waterstofatomen zijn. Hij N-Hexano is daarom een koolwaterstof, lineair en zeer dynamisch.
Omdat al zijn C-H-banden lage polariteit zijn, mist het molecuul het dipoolmoment. Daarbij zijn de intermoleculaire interacties ervan niet van het dipool-dipol.
Elk molecuul van N-Hexano "past" de ene bovenop de andere bij zeer lage temperaturen, zoals het zou worden aangenomen in zijn kristallijne structuur. Aan de andere kant buigen hun skeletten in de vloeistof en roteren hun C-H-bindingen, afkomstig uit dat genoemde vloeistof vluchtig is en kookt op 68,7 ºC.
Isomeren
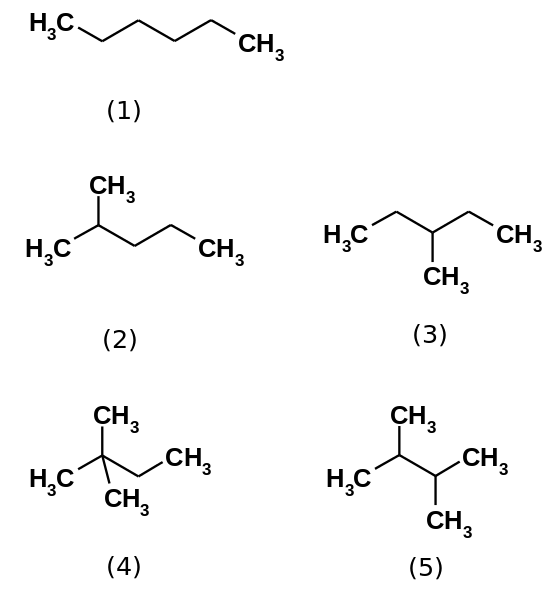 De vijf hexane -isomeren. Bron: Steffen 962 [Public Domain]
De vijf hexane -isomeren. Bron: Steffen 962 [Public Domain] Hexaankoolwaterstof bestaat eigenlijk uit vijf isomeren, die de N-Hexaan het minst vertakt, (1). De andere vier isomeren zijn in toenemende volgorde:
2-methylpropaan (2)
3-methylpropaan (3)
2,2-dimethylbutaan (4)
2,3-dimethylbutaan (5)
Merk op dat de structuren meer vertakt van (1) tot (5). Omdat ze meer vertakt zijn, nemen dispersieve krachten af, omdat er geen lineaire delen langer zijn die efficiënt genezen. Dit leidt tot een afname en variatie van de kookpunten van de isomeren; Hoewel bepaalde acceptabele discrepanties worden waargenomen.
Kan u van dienst zijn: wat is de erristeneo?Beide 2-methylpropaan. Vervolgens wordt het gevolgd door 2,3-dimethylbutaan (PEB = 58 ºC), om uiteindelijk 2,2-dimethylbutaan te plaatsen als de meest vluchtige vloeistof (PEB = 49,7 ºC).
Toepassingen
Hexaan wordt gemengd met vergelijkbare chemicaliën om oplosmiddelen te produceren. Onder de namen die deze oplosmiddelen ontvangen, zijn commercieel hexaan, gemengde hexans, enz. Ze worden gebruikt als schoonmaakmiddelen in de textielindustrie, meubels en holle afdrukken.
Hexaan is een ingrediënt van de lijm die wordt gebruikt in de waterdichting van daken, in schoeisel en leer. Het wordt ook gebruikt om boeken te binden, pillen en tabletten te vormen, spoelen, banden en honkbalballen te maken.
Hexaan wordt gebruikt bij het bepalen van de minerale brekingsindex en het vullen van vloeistof voor de thermometers in plaats van kwik; Over het algemeen met een rode of blauwe kleurstof. Het wordt ook gebruikt bij de extractie van vet en waterolie voor de analyse van zijn verontreinigende stoffen.
Hexano wordt gebruikt als een oplosmiddel bij de extractie van plantenzaadolie, zoals sojabonen, canola of bit. Bovendien wordt het gebruikt om stukken verschillende oorsprong te debat. Het wordt gebruikt in alcohol denaturatie, in de HPLC -analysemethode en spectrofotometrie.
Toxiciteit
Inademing en contact
De acute toxiciteit van hexaan is relatief laag, hoewel het een milde verdoving is. Acute blootstelling aan hoge hexaanconcentraties kunnen veroorzaken door inademing, milde depressie van het centrale zenuwstelsel (CZS), dat zich manifesteert door duizeligheid, duizeligheid, milde misselijkheid en hoofdpijn.
Kan u van dienst zijn: endotherme reactieHet kan ook dermatitis en de irritatie van de ogen en keel veroorzaken. Chronische hexaaninademing, gerelateerd aan werkactiviteit, kan schade aan het perifere zenuwstelsel veroorzaken (sensomotorische polyneuropathie).
De eerste symptomen zijn tintelingen en beenkrampen en armen, gevolgd door spierzwakte. In ernstige gevallen kan er een atrofie van skeletspieren zijn, samen met verlies van coördinatie en gezichtsproblemen.
Hexaantoxiciteit houdt verband met het genereren van hexaan-2,5-diona metaboliet. Dit reageert met de aminozuurlysine van een eiwit laterale keten, waardoor het verlies van eiwitfunctie wordt geproduceerd.
Veilige dosis
Het Enviromental Protection Agency (EPA) berekende een referentieconcentratie (RFC) voor het 0,2 mg/m hexaan3, en een referentiedosis (RFD) van 0,06 mg/kg gewicht/dag.
In de jaren zestig en zeventig, de aanwezigheid van zenuwveranderingen. De oorzaak was dat ze een sfeer van hexaan van 500 - 2 inademden.500 ppm, gedurende 8-14 uur per dag.
De werknemers presenteerden de bekende symptomen van de chronische inhalatie van hexano en ontdekten de artsen dat de zenuwen die de spieren van de armen en benen controleerden, beschadigd waren.
Referenties
- Danielle Reid. (2019). Hexane: structuur, formule en eigenschappen. Studie. Hersteld van: studie.com
- Nationaal centrum voor biotechnologie -informatie. (2019). Hexaan. PubChem -database. CID = 8058. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Hexaan. Opgehaald uit: in.Wikipedia.borg
- Wereld van moleculen. (S.F.)). Hexaanmolecuul. Hersteld van: Worldofmolecules.com
- Chemisch boek. (2017). Hexaan. Hersteld van: chemisch boek.com
- Gemenebest van Australië. (S.F.)). N-hexane: bronnen van kwesties. Hersteld van: npi.Gov.Au
- EPA. (2000). Hexaan. [PDF]. Hersteld van: EPA.Gov
- Agentschap voor giftige stoffen en ziektegister. (1999). Pub Pub Health Statement voor N-HEXAN. Opgehaald van: ATSDR.CDC.Gov
- « 5 Chemische reacties Experimenten (eenvoudig en veilig)
- Toronjil -kenmerken, habitat, eigenschappen, teelt, zorg »

