Halogenen
- 1814
- 101
- Aaron Okuneva
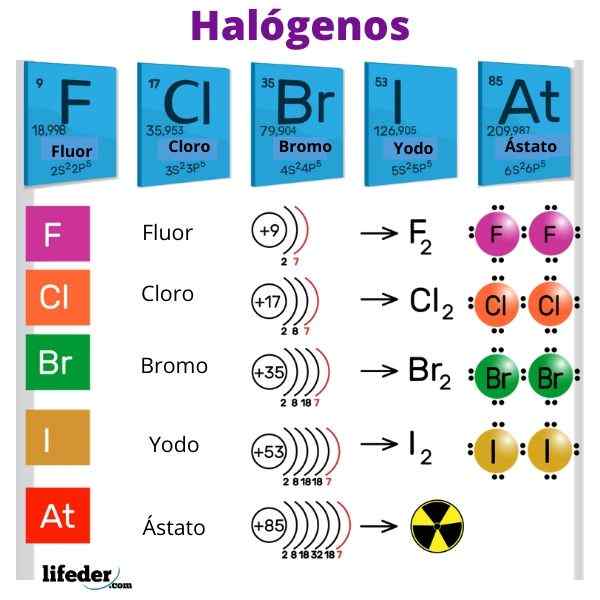
 De elementen zijn 5: fluoride, chloor, broom, jodium en herstaat
De elementen zijn 5: fluoride, chloor, broom, jodium en herstaat Wat zijn halogenen?
De halogenen Het zijn niet -metalen elementen die behoren tot groep VIIA of 17 van het periodiek systeemtabel. Ze hebben hoge elektronische elektronegativiteiten en affiniteiten, die veel invloed hebben op het ionische karakter van hun banden met metalen. Het woord 'halogeno's' is van Griekse oorsprong en betekent "zouten van zouten".
De halogenen zijn fluoride (F), chloor (CL), broom (BR), jodium (I) en het radioactieve en efemere element Ástato (AT). Ze zijn zo reactief dat ze met elkaar reageren om diatomaire moleculen te vormen: f2, Klet2, BR2, Je2 en op2.
Deze moleculen worden gekenmerkt door vergelijkbare structurele eigenschappen (lineaire moleculen) te hebben, hoewel met verschillende fysische toestanden.
Wat is het uiterlijk van halogenen?
In de onderste afbeelding worden drie halogenen getoond. Van links naar rechts: chloor, broom en jodium. Fluor noch janteaat kunnen worden opgeslagen in glazen containers, omdat de laatste hun corrosiviteit niet weerstaat. Merk op hoe de organoleptische eigenschappen van halogenen veranderen naarmate hun groep afdaalt naar het jodiumelement.
 Halogenens uiterlijk. Bron: Bron: door W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)], via Wikimedia Commons
Halogenens uiterlijk. Bron: Bron: door W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)], via Wikimedia Commons Fluor is een gas van geelachtige tonen; Chloor ook, maar geelgroen; Bromo is een donkere roodachtige vloeistof; Het jodium, een zwarte vaste stof met Violet Visos; En de astat, een donkere en heldere metalen vaste stof.
De halogenen kunnen reageren met bijna alle elementen van het periodiek systeem, zelfs met enkele edelgassen (zoals Xenon en Kripton). Als ze dat doen, kunnen ze atomen oxideren tot hun meest positieve oxidatietoestanden, waardoor ze krachtige oxidatiemiddelen zijn.
Evenzo geven ze specifieke eigenschappen aan moleculen wanneer sommige van hun atomen zijn gekoppeld of vervangen. Dit soort verbindingen worden haluros genoemd. Haluros vormen in feite de belangrijkste natuurlijke bron van halogenen, en velen van hen zijn opgelost in de zee of maken deel uit van een mineraal; Dat is het geval van fluoriet (CAF2)).
Zowel halogenen als haluros hebben een breed scala aan gebruik, van industrieel of technologisch, om eenvoudig de smaak van bepaalde voedingsmiddelen te benadrukken, zoals het edelsteenzout (natriumchloride) doet (natriumchloride).
Fysische en chemische eigenschappen van halogenen
Atomaire gewichten
Fluoride (F) 18,99 g/mol; Chloor (CL) 35,45 g/mol; Bromo (Br) 79,90 g/mol; Jodium (i) 126,9 g/mol en astato (AT) 210 g/mol.
Fysieke staat
F gas; Gaseous CL; Vloeistof; Ik ben solide en solide.
Kleur
F, lichtgeelgrind; CL, lichtgroen; BR, roodbruin; I, Violet en At, Metallic Black * * (aangenomen)
Fusiepunten
F -219.6º C; CL -101,5º C; Br -7.3º C; I 113.7º C en bij 302º C.
Kookpunten
F -118.12º C; CL -34.04º C; BR 58.8º C; I 184.3º C en ?Bij 337º C.
Dichtheid bij 25 ° C
F- 0,0017 g/cm3; CL- 0,0032 g/cm3; Br- 3.102 g/cm3; I- 4.93 g/cm3 en AT- 6.2-6.5 g/cm3
Oplosbaarheid in water
CL- 0,091 mmol/cm3; Br- 0,21 mmol/cm3 en i- 0,0013 mmol/cm3.
Ionisatieenergie
F- 1.681 kJ/mol; Cl- 1.251 kJ/mol; Br- 1.140 kJ/mol; I- 1,008 kJ/mol en AT-890 kJ/mol.
Elektronegativiteit
F- 4.0; Cl- 3.0; 2,8; I- 2,5 en AT- 2,2.
De halogenen hebben 7 elektronen in hun valentielaag, vandaar hun grote aviditeit om een elektron te winnen. Halogenen hebben ook een hoge elektronegativiteit vanwege hun kleine atoomradio's en de grote aantrekkingskracht die de kern op de elektronen van Valencia uitoefent.
Kan u van dienst zijn: massa -actiewetgevingReactiviteit
Halogenen zijn zeer reactief, wat dan hun toxiciteit zou verklaren. Bovendien zijn ze oxiderende middelen.
De afnemende volgorde van reactiviteit is: f> cl> b> i> bij.
Staat in de natuur
Vanwege hun grote reactiviteit zijn halogeenatomen niet vrij van aard, maar vormen ze aggregaten of als diatomaire moleculen gekoppeld door covalente bindingen.
Moleculaire structuren
Halogenen bestaan niet in de natuur als elementaire atomen, maar als diatomaire moleculen. Ze hebben echter allemaal gemeen een lineaire moleculaire structuur, en het enige verschil ligt in de lengte van hun links en in hun intermoleculaire interacties.
De X-X lineaire moleculen (x2) Ze worden gekenmerkt door onstabiel te zijn, omdat beide atomen het paar elektronen sterk aantrekken. Omdat? Omdat zijn externe elektronen een zeer hoge effectieve nucleaire belasting ervaren, ZEF. Een grote ZEF, minder zal de afstand zijn van de X-X-link.
Naarmate de groep afdaalt, wordt ZEF zwakker en neemt de stabiliteit van deze moleculen toe. Dus de afnemende volgorde van reactiviteit is: F2> Cl2> Br2> I2. Het is echter onverenigbaar om de ostaat te vergelijken met fluor, omdat het een onbekende isotoop is.
Intermoleculaire interacties
Aan de andere kant missen de moleculen een dipoolmoment, zijnde apolair. Dit feit is verantwoordelijk voor zijn zwakke intermoleculaire interacties, waarvan de enige latente kracht dispersie is of Londen, wat evenredig is met atomaire massa en moleculair gebied.
Op deze manier is het kleine molecuul van F2 heeft niet genoeg massa of elektronen om een vaste stof te vormen. In tegenstelling tot ik2, Het jodiummolecuul, dat toch een vaste stof blijft die paarse dampen afgeeft.
Bromo vertegenwoordigt een tussenliggend voorbeeld tussen beide uiteinden: BR -moleculen2 Ze communiceren genoeg om in vloeibare toestand te verschijnen.
Het herstaat, waarschijnlijk vanwege het groeiende metalen karakter, presenteert zich niet als bij2 Maar als atomen van Athe vormen metalen links.
Wat betreft de kleuren (geelgeel groenachtig rood-mudad-neger), is de meest geschikte verklaring gebaseerd op de moleculaire orbitale theorie (TOM). De energieafstand tussen het laatste volledige moleculaire orbitaal en de volgende grotere energie (antienlace) wordt overschreden door absorptie van een foton met steeds grotere en grotere golflengten.
Haluros
Halogenen reageren op haluros, ongeorgereel of organisch. De bekendste zijn waterstofhalogeniden: waterstoffluoride (HF), waterstofchloride (HCl), waterstofbromide (HBR) en waterstofjodide (HI).
Allemaal opgelost in water genereren zure oplossingen; Zo zuur, dat HF elke glazen container kan afbreken. Bovendien worden uitgangsmaterialen overwogen voor de synthese van extreem sterke zuren.
Er zijn ook de zo -called metaalhalogeniden, die chemische formules hebben die afhankelijk zijn van de metaal Valencia. Alkalische metalen halogeniden hebben bijvoorbeeld MX -formule, en onder hen zijn: NaCl, natriumchloride; KBR, kaliumbromide; CSF, cesiumfluoride; en lii, lithiumjodide.
De alkalinotherreuze metalen, overgangsmetalen of metalen van het P -blok hebben een MX -formuleN, N de positieve metaalbelasting zijn. Sommige voorbeelden van hen zijn dus: fecl3, ijzertrichloride; Mgbr2, magnesiumbromide; Alf3, Aluminium trifluoruro; en CUI2, Cupric jodide.
Kan u dienen: kaliumsulfaat (k2SO4): structuur, eigenschappen, gebruik, syntheseHalogenen kunnen echter ook links vormen met koolstofatomen; Daarom kunnen ze interfereren in de complexe wereld van organische chemie en die van biochemie. Deze verbindingen worden organische halogeniden genoemd en zijn over het algemeen chemische formule, als X een van de halogenen.
Gebruik/halogeentoepassingen
Chloor
In de industrie
-Bromo en chloor worden in de textielindustrie gebruikt om wol te bleken en te behandelen, waardoor je krimpen vermijdt wanneer je nat wordt.
-Het wordt gebruikt als een ditritus -desinfectiemiddel en voor de zuivering van drinkwater en zwembaden. Bovendien worden van chloor -afgeleide verbindingen gebruikt in wasseries en in de papieren industrie.
-Vind gebruik bij de productie van speciale batterijen en gechloreerde koolwaterstoffen. Het wordt ook gebruikt bij de verwerking van vlees, groenten, vis en fruit. Chloor werkt ook als bacteriedodend middel.
-Het wordt gebruikt om leer schoon te maken en af te wijzen en cellulose te bleken. Vroeger werd stikstoftrichloride gebruikt als blender- en bloemconditioner.
-Fosfeengas (cocl2) Het wordt gebruikt in tal van industriële syntheseprocessen, evenals bij de productie van militaire gassen. Het fosfaan is erg giftig en is verantwoordelijk voor tal van doden in de Eerste Wereldoorlog, waar gas werd gebruikt.
-Dit gas wordt ook gevonden in insecticiden en ontsmettingen.
-NaCl is een zeer overvloedig zout dat wordt gebruikt om voedsel te kruiden en in het behoud van vee en vogelvlees. Bovendien wordt het gebruikt in lichamelijke rehydratatievloeistoffen, zowel oraal als intraveneus.
In de geneeskunde
-Halogeenatomen die binden aan geneesmiddelen maken ze lipofieler. Hierdoor kunnen medicijnen gemakkelijker celmembranen doorlopen die oplossen in de lipiden die het vormen.
-Het chloor wordt verspreid in het binnenland van de neuronen van het centrale zenuwstelsel door ionische kanalen gekoppeld aan de neurotransmitter GABA -receptoren, waardoor een sedatief effect wordt geproduceerd. Dit is het werkingsmechanisme van verschillende anxiolytica.
-De HCL is aanwezig in de maag, waar het tussenbeide komt en een reducerende omgeving creëert die de voedselverwerking begunstigt. Bovendien activeert de HCl het pepsine, een enzym dat de hydrolyse van de eiwitten begint, een stadium voorafgaand aan de darmabsorptie van het eiwitmateriaal.
Anderen
-Het zoutzuur (HCL) wordt gebruikt bij het reinigen van de badkamers, in onderwijs- en onderzoekslaboratoria en in talloze industrieën.
-PVC (polyvinylchloride) is een vinylchloride polymeer dat wordt gebruikt in kleding, vloeren voor vloeren, elektrische kabels, flexibele buizen, buizen, opblaasbare structuren en dakpannen. Bovendien wordt chloor gebruikt als intermediair bij de uitwerking van andere plastic materialen.
-Chloor wordt gebruikt bij broomextractie.
-Methylchloride vervult een verdovingsfunctie. Het wordt ook gebruikt bij de uitwerking van bepaalde siliconenpolymeren en bij de extractie van vetten, oliën en harsen.
-Chloroform (chcl3) is een oplosmiddel dat in veel laboratoria wordt gebruikt, vooral in organische en biochemiechemielaboratoria, van lesgeven tot onderzoekers.
-En ten slotte, met betrekking tot chloor, wordt trichloorethyleen gebruikt om metaalonderdelen af te leggen.
Broom
-BROMO wordt gebruikt in het goudmijnwinningsproces en bij het boren van olie- en gasbronnen. Het wordt gebruikt als een verbrandingsvertrager in de plastic en gasindustrie. Bromo isoleert zuurstofvuur waardoor het wordt uitgeschakeld.
Kan u van dienst zijn: natriummetabisulfiet (NA2S2O5): structuur, eigenschappen, gebruik, risico's-Het is een tussenpersoon bij de productie van hydraulische vloeistoffen, koelmiddelmiddelen en ontvochtigers en bereid om haar te vormen. Kaliumbromide wordt gebruikt bij de productie van platen en fotografische papieren.
-Kaliumbromide wordt ook gebruikt als anticonvulsief, maar vanwege de mogelijkheid dat zout neurologische disfuncties kan veroorzaken, is het gebruik ervan verminderd. Bovendien is een andere van zijn gemeenschappelijke toepassingen als een pil voor vaste monsters van infraroodspectroscopie.
-Bromo -verbindingen zijn aanwezig in medicijnen die worden gebruikt bij de behandeling van longontsteking. Evenzo worden broomverbindingen opgenomen in medicijnen die worden gebruikt in de tests die worden uitgevoerd bij de behandeling van de ziekte van Alzheimer.
-Bromo wordt gebruikt om kwikvervuiling te verminderen in elektrische planten die steenkool gebruiken als brandstof. Het wordt ook gebruikt in de textielindustrie om verschillende kleurverf te maken.
-Methylbrominaat werd gebruikt als pesticide voor fumigatie van bodem en huizen, maar het schadelijke effect op ozon heeft het gebruik ervan beperkt.
-Halogeenlampen zijn gloeiend en het aggregaat van kleine hoeveelheden broom en jodium maakt een vermindering van de grootte van de bollen mogelijk.
Jodium
-Jodium komt tussenbeide in het functioneren van de schildklier, regulerend hormoon van het lichaamsmetabolisme. De schildklier schekt de hormonen T3 en T4 uit, die hun actie uitoefenen op hun witte organen. Hormonale werking op hartspier veroorzaakt bijvoorbeeld een toename van de bloeddruk en hartslag.
-Evenzo wordt jodium gebruikt bij de identificatie van de aanwezigheid van zetmeel. Silver Yoduro is een reagens dat wordt gebruikt bij de openbaring van de foto's.
Fluor
-Sommige fluorideverbindingen worden aan tandheelkundige pasta's toegevoegd om het uiterlijk van cariës te voorkomen. Fluorderivaten zijn aanwezig in verschillende anesthetica. In de farmaceutische industrie nemen ze fluoride op aan medicijnen om mogelijke verbeteringen op hun effecten op het lichaam te bestuderen.
-Fluorhorinezuur wordt gebruikt om glas vast te leggen. Ook bij de productie van halons (brandblussergassen, zoals de Fry). Een fluorideverbinding wordt gebruikt bij aluminium elektrolyse om zijn zuivering te bereiken.
-Antirreflejantes -coatings bevatten een fluorverbinding. Dit wordt gebruikt bij de productie van plasmaschermen, flatscreens en micro -elektromechanische systemen. Fluor is ook aanwezig in de klei die in sommige keramiek wordt gebruikt.
Herformuleren
Er wordt gedacht dat het herstaat zou kunnen bijdragen aan jodium bij de regulering van het functioneren van de schildklier. Ook zijn radioactieve isotoop (210Bij) is gebruikt in kankerstudies bij muizen.
Referenties
- Encyclopedie van gezondheid en veiligheid op het werk. Halogenen en zijn verbindingen. [PDF]. Genomen van:
- werkgelegenheid.Gok.is
- Chemistry Libhethexts. Groep 17: Algemene eigenschappen van halogenen. Genomen uit: chem.Librhetxts.borg
- Wikipedia. (2018). Halogeen. Genomen van: in.Wikipedia.borg
- Jim Clark. (Mei 2015). Atomische en fysische eigenschappen van de elementen van de groep 7 (de halogenen). Uitgebracht van: ChemGuide.co.Uk
- Whitten, K. W., Davis, r. EN., Peck, m. L. En Stanley, G. G. Chemistry (2003), 8e ed. Cengage leren.
- Items. Halogenen. Genomen uit: elementen.borg.is
- Bruin, laurier. (24 april 2017). Halogeenkenmerken. Wetenschap. Hersteld van: wetenschap.com

