Gilbert Newton Lewis
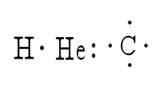
- 1685
- 484
- Ernesto McKenzie
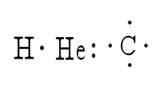 Gilbert Newton Lewis
Gilbert Newton Lewis Gilbert Newton Lewis (1875-1946) was een van de belangrijkste Amerikaanse wetenschappers van de twintigste eeuw. Zijn werk produceerde een structurele revolutie in chemische studies, dankzij de meerdere bijdragen die hij gedurende zijn hele leven heeft geleverd voor de ontwikkeling van de wetenschap.
Een van de bijdragen van dit fysicochemisch onderscheidt de formule die zijn naam draagt, waarmee de paren elektronen grafisch worden weergegeven. Lewis 'onderzoekswerk was erg breed, hoewel zijn bekendheid in feite te wijten was aan de theorie van chemische bindingen en de definitie van zuur-base zuur in 1923.
Lewis werd grote invloed op de wetenschappelijke en academische wereld van de Verenigde Staten, vooral aan de Harvard University, waar voorzitter werd gevormd en dicteerde. Zijn werk voor het Amerikaanse leger tijdens de Eerste Wereldoorlog verdiende hem de grootste erkenning en de hoogste onderscheidingen.
Het werd gevormd aan de universiteiten van Nebraska, Harvard, Leipzig en Gontinga in Duitsland. Hij werkte aan het Massachusetts Institute (MIT), aan de Harvard University en aan de Universiteit van Californië, waar hij stierf.
Gedurende zijn hele leven ontving hij ontelbare erkenning en prijzen, waaronder verschillende ere -doctoraten van Chicago, Madrid, Liverpool, Wisconsin en Pennsylvania opvallen. Hij was erelid van verschillende wetenschappelijke instellingen in Engeland, India, Zweden, Denemarken en de Verenigde Staten.
Biografie
Geboorte en vroege jaren
Gilbert Newton Lewis werd geboren in Weymouth, Massachusetts, op 23 oktober 1875. Zijn ouders waren Frank Wesley Lewis en Mary Burr White Lewis. Tijdens zijn vroege jaren ontving hij leringen in zijn eigen huis en op 10 -jarige leeftijd ging hij naar de openbare school, waar hij in 1889 afstudeerde.
In 1884 moest Lewis zich vestigen met zijn familie in Lincoln, Nebraska. Op 13 -jarige leeftijd werd hij opgenomen op de middelbare school van de Universiteit van Nebraska.
Kan u van dienst zijn: berylliumhydride (Beh2)Bestuderen
Toen hij afstudeerde, ging hij twee jaar door met zijn universitaire studies en schreef zich vervolgens in aan de Harvard University in 1893.
Aanvankelijk was hij geïnteresseerd in de economie, maar koos hij uiteindelijk voor natuurkunde en chemie. Gilbert verkreeg zijn titel in chemie in 1896 en een jaar lang gaf hij les aan Phillips Academy, een privéschool voor Andover.
Hij keerde terug naar Harvard om het postdoctorale werk te doen en de master in 1898 te behalen met zijn scriptie over Het elektron en een molecuul. Een jaar later was het doctoraat en zijn scriptie getiteld Sommige elektrochemische en thermochemische relaties van zink- en cadmium amalgamen".
In Harvard diende hij een jaar als instructeur en reisde hij vervolgens naar Europa met een beurs. Hij studeerde met de grote fysicochemicaliën van die tijd.
In 1899 reisde hij naar Duitsland om te studeren met Wilhelm Ostwald Leipzig en vervolgens met Walter Nernst aan de Universiteit van Gontinga; Toen werkte hij voor de Filipijnse regering.
Academisch werk en deelname aan oorlog
Tussen 1999 en 1906 publiceerde hij een chemie -voorzitter aan de Harvard University en vervolgens aangenomen door het Massachusetts Institute of Technology, waar hij van 1907 tot 1912 was.
Later werd hij hoogleraar fysische chemie aan de Universiteit van Californië (Berkeley), waar hij de graad van Dean of the School of Chemistry behaalde.
In 1908 publiceerde hij zijn eerste artikel over de relativiteitstheorie in parallellisme met Albert Einstein. Hierin stelt het vast dat er een verband bestaat tussen de energiemasa, maar in een andere richting dan die van Einstein.
Op 21 juni 1912 trouwde Lewis met Mary Fanckley Sheldon, met wie hij drie kinderen had: Margery S. Lewis, Edward S. Lewis en Richard Newton Lewis.
Het kan u van dienst zijn: giberéliczuur: kenmerken, synthese, functiesZijn werk in Californië werd onderbroken door het uitbreken van de Eerste Wereldoorlog I. In 1917 kreeg hij de opdracht om voor het Amerikaanse leger te werken, waar hij hoofd werd van de Division of Defence of the Chemical War Service.
Lewis's levering en werkcapaciteit stond het leger toe. Aan het einde van de oorlog werd hij bekroond voor zijn diensten met de hoogste onderscheidingen.
Dood in het laboratorium
Gilbert n. Lewis stierf op 70 -jarige leeftijd voor een hartaanval toen hij op 23 maart 1946 in zijn laboratorium aan de Universiteit van Berkeley werkte.
Misschien vanwege de introverte persoonlijkheid, heeft deze eminente wetenschapper nooit de Nobelprijs ontvangen. Bijna aan het einde van zijn carrière slaagde hij erin te bewijzen dat de fosforescentie van organische moleculen wordt beheerst door een opgewonden triplet -toestand, zelfs het berekenen van de magnetische eigenschappen.
Bijdragen aan de wetenschap
Sommige van de belangrijkste bijdragen van Gilbert Newton Lewis aan de wetenschap zijn de volgende:
Lewis -structuren
Het zijn verschillende methoden die dienen om de structuur van een molecuul weer te geven. Hierin vertegenwoordigen de symbolen van de elementen atomen, terwijl de punten de elektronen vertegenwoordigen eromheen. Een voorbeeld hiervan is de weergave van waterstof, helium en koolstof:
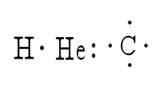
Lewis was de eerste die het idee voorstelde dat atomen verenigd konden blijven door elektronenparen te vergelijken; Daarom creëerde hij de symboliek van de structuren.
De brede link -theorie voorgesteld door Lewis diende om in één concept alle soorten chemische links te groeperen. Op deze manier werden de relaties tussen ionische, moleculaire, covalente en metaalachtige stoffen aangetoond. Tot die tijd hadden deze elementen geen conceptuele verbinding gehad.
Kan u van dienst zijn: Type link van 02Covalente binding
De covalente binding die zich vormt tussen twee atomen wanneer ze zich aansluiten om een stabiel octet te bereiken en elektronen van het laatste niveau te bereiken, behalve voor waterstof, die erin slaagt om stabiliteit te bereiken door 2 elektronen te hebben.
Octettheorie
Het werd in 1916 vermeld door Lewis. Dit stelt vast dat de ionen die tot de elementen van het periodieke systeem behoren, de neiging hebben om met een aantal van 8 elektronen hun nieuwste energieniveaus te voltooien. Hierdoor kunnen ze een zeer stabiele configuratie verwerven.
Foton
Het was de maker in 1926 van de term foton om de kleinste eenheid van lichte energie aan te duiden. Dit energiedeeltje zendt alle bestaande vormen van elektromagnetische straling over (x -reeks, infrarood, gamma, ultraviolet, magnetrons, radiogolven, enz.)).
Chemische aantrekkingskracht en Valencia
Samen met zijn chemische collega Irwing Langmir ontwikkelde hij de theorie van aantrekkingskracht en chemische valentie, die bekend staat als Langmuir-Lewis-theorie. Hiervoor was het gebaseerd op de atomaire structuur van stoffen.
Zwaar water
Lewis was ook de eerste wetenschapper die in zijn puurste vorm studeerde en zwaar water (Deuterium) produceerde en produceerde. Hij was ook de eerste die de principes van de thermodynamica toepast in de studie van chemische problemen.
Ontbindingstheorie
Evenzo wordt Lewis zijn werk erkend over de theorie van oplossingen; dat wil zeggen, de homogene mengsels verkregen uit de interpositie van atomen, moleculen of ionen aanwezig in twee of meer stoffen. Deze stoffen die componenten worden genoemd, komen tussenbeide in verhoudingen die variëren.

