Gassenseigenschappen, gedrag, vorm, voorbeelden

- 1013
- 156
- Aaron Okuneva
De Gassen Het zijn al die stoffen of verbindingen waarvan de aggregatietoestanden zwak en verspreid zijn, terwijl sterk afhankelijk is van de druk- en temperatuuromstandigheden die hen regelen. Vormen misschien de tweede vorm van materie die in het hele universum overvloediger overvloediger aanwezig is na plasma.
Op aarde vormen de gassen de lagen van de atmosfeer, van de exosfeer tot de troposfeer en de lucht die we inademen. Hoewel een gas onzichtbaar is wanneer het wordt verspreid door grote ruimtes, zoals de hemel, wordt het gedetecteerd door de beweging van de wolken, de bochten van de messen van een molen of de uitgeademde dampen van onze mond in koude klimaten.
 Gassen kunnen worden waargenomen in industriële of thuisschoorstenen, evenals in rooktorens die door vulkanen uitgaan. Bron: Pxhere.
Gassen kunnen worden waargenomen in industriële of thuisschoorstenen, evenals in rooktorens die door vulkanen uitgaan. Bron: Pxhere. Evenzo, naar de negatieve aspecten van het milieu, wordt het waargenomen in de zwarte rook van de uitlaatpijp van de voertuigen, in de rookkolommen van de torens in de fabrieken, of in de rook die wordt verhoogd wanneer een bos brandt.
Het wordt ook geconfronteerd met gasvormige fenomenen wanneer dampen worden gezien die de riolen verlaten, in de noodlottige branden van het moeras en de begraafplaatsen, in de Bubb -zuurstof die wordt vrijgegeven door het plantenproduct van hun fotosynthese, en zelfs in de eres en winderigheid.
Overal waar de gassen worden waargenomen, betekent dit dat er een chemische reactie was, tenzij ze rechtstreeks uit de lucht zijn gefixeerd of geassimileerd, de hoofdbron van gassen (oppervlakkig) van de planeet. Naarmate de temperaturen stijgen, zal elke stof (chemische elementen) worden omgezet in gassen, inclusief metalen zoals ijzer, goud en zilver.
Ongeacht de chemische aard van gassen, deelt iedereen gemeen de grote afstand die hun deeltjes scheidt (atomen, moleculen, ionen, enz.), die chaotisch en willekeurig bewegen door een specifiek volume of ruimte.
[TOC]
Gaseigenschappen
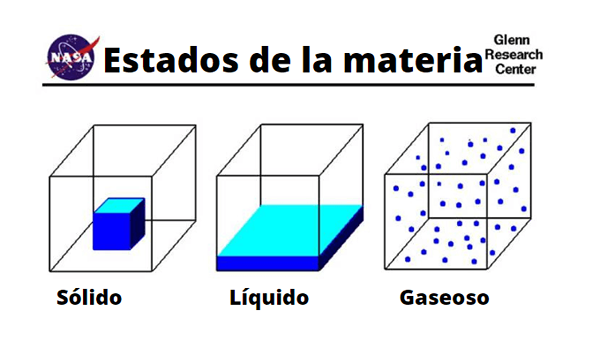 Verschillen in vaste, vloeistof- en gasmoleculen
Verschillen in vaste, vloeistof- en gasmoleculen Fysiek
De fysische eigenschappen van gassen variëren afhankelijk van welke stof of verbinding is. In de volksmond worden de gassen geassocieerd met slechte geuren of rot, vanwege hun zwavelgehalte, of voor de aanwezigheid van vluchtige amines. Evenzo worden ze gevisualiseerd door groene, bruine of geelachtige kleuringen, die intimideren en een slecht voorteken geven.
De meeste gassen, of op zijn minst de meest voorkomende, zijn echter eigenlijk kleurloos en geurloos. Zelfs als ze niet -assistent zijn, kunnen ze op de huid worden gevoeld en zich verzetten tegen bewegingsweerstand, zelfs het creëren van viskeuze lagen in de lichamen die hen kruisen (zoals bij de vliegtuigen).
Alle gassen kunnen druk of temperatuurveranderingen ervaren die uiteindelijk hun respectieve vloeistoffen maken; dat wil zeggen, ze lijden aan condensatie (als ze worden gekoeld) of vloeibaarmaking (als ze "geperst" zijn).
 Condensatie; van gasvormige toestand tot vloeibare toestand
Condensatie; van gasvormige toestand tot vloeibare toestand Aan de andere kant zijn gassen in staat om op te lossen in vloeistoffen en enkele poreuze vaste stoffen (zoals geactiveerde koolstof). Bubbels zijn het resultaat van gasclusters die nog niet in het midden zijn opgelost en ontsnappen naar het vloeibare oppervlak.
Elektrische en thermische geleidbaarheid
Onder normale omstandigheden (zonder ionisatie van hun deeltjes) zijn gassen slechte drijfveren van warmte en elektriciteit. Wanneer ze echter gespannen zijn met veel elektronen, staan ze de doorgang van de stroom door hen toe, zoals te zien in de stralen tijdens de stormen.
Aan de andere kant, bij lage drukken en onderworpen aan een elektrisch veld, worden sommige gassen, vooral de nobele of perfecte, illuminaten en hun lichten gebruikt voor het ontwerp van het nachtleven en posters (neon licht), evenals in de beroemde elektrische schok Lampen op straatlantaarns.
Kan u van dienst zijn: Granataria -balans: kenmerken, onderdelen en hoe u deze kunt gebruikenWat betreft de thermische geleidbaarheid, gedragen veel gassen zich als thermische isolatoren, zodat hun opname in het vullen van vezels, weefsels of glazen panelen helpt voorkomen dat warmte ze brouwt en de temperatuur constant houdt.
Er zijn echter gassen die goede warmtegeleiders zijn en slechtere brandwonden kunnen veroorzaken die worden veroorzaakt door vloeistoffen of vaste stoffen; Bijvoorbeeld, zoals bij de hete stoom van gebakken cakes (of empanadas), of met stoomstralen die aan de ketels ontsnappen.
Reactiviteit
Over het algemeen worden de reacties met gassen, of waar ze optreden, beschreven als gevaarlijk en omslachtig.
Zijn reactiviteit hangt opnieuw af van hun chemische aard; Wanneer echter sterk uitbreidend en mobiliseren, moet er meer zorg en controle worden genomen omdat ze drastische druk kunnen veroorzaken die de structuur van de reactor in gevaar brengen; Om nog maar te zwijgen van hoe ontvlambaar of geen gelukkige gassen zijn.
Gasedrag
Macroscopisch kan men een idee geven van het gedrag van gassen door getuige te zijn van hoe rook, ringen of literaire "talen" van sigaretten evolueren in de lucht. Ook wanneer een rookgranaat explodeert, is het interessant om de beweging van deze wolken van verschillende kleuren te beschrijven.

Dergelijke waarnemingen zijn echter onderhevig aan luchtactie, en ook aan het feit dat er zeer fijne vaste deeltjes zijn opgehangen in rook. Daarom zijn deze voorbeelden niet voldoende om tot een conclusie te komen met betrekking tot het ware gedrag van een gas. In plaats daarvan zijn experimenten uitgevoerd en de kinetische theorie van gassen ontwikkeld.
Moleculair en idealiter botsen gasvormige deeltjes elastisch tegen elkaar, met lineaire, rotatie- en trillingsverplaatsingen. Ze hebben een gemiddelde bijbehorende energie, waardoor het vrij door elke ruimte kan reizen zonder bijna te communiceren of te botsen met een ander deeltje naarmate het volume om hen heen toeneemt.
Het gedrag zou een mengeling zijn van de Brownse onregelmatige beweging, en die van botsingen van biljartballen die onophoudelijk tegen elkaar en de muren van de tafel stuiteren; Als er geen muren zijn, zullen ze zich verspreiden naar oneindig, tenzij ze ze behouden: zwaartekracht.
Gansvorm
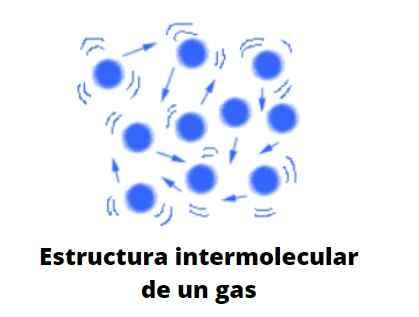
Gassen, in tegenstelling tot vloeistoffen en vaste stoffen, zijn niet onderworpen aan het gecondenseerde type; dat wil zeggen, de aggregatie of cohesie van hun deeltjes slaagt er nooit in om een vorm te definiëren. Ze delen met vloeistoffen het feit dat ze het volume van de container die ze bevatten volledig bezetten; Ze missen echter oppervlakte- en oppervlaktespanning.
Als de gasconcentratie hoog is, kunnen uw reeds beschreven "talen" of macroscopische vormen worden gevisualiseerd met het blote oog. Deze zullen vroeg of laat vervagen vanwege de actie van de wind of door de loutere uitbreiding van het gas. Gassen bedekken daarom alle hoeken van beperkte ruimte die zeer homogene systemen veroorzaken.
Nu beschouwt de theorie gassen handig als bollen die nauwelijks tegen zichzelf botsen; Maar als ze dat doen, stuiteren ze elastisch.
Deze bollen zijn zeer van elkaar gescheiden, dus de gassen zijn praktisch "vol" van vacuüm; Van daaruit ben je je veelzijdigheid verschuldigd om de minste spleet of splijting over te steken, en het gemak om ze aanzienlijk te kunnen comprimeren.
Kan u van dienst zijn: niet -metalen oxidenDat is de reden waarom, hoe de installatie van een bakkerij ook is gesloten, als het aan de zijkant loopt, is het zeker dat het aroma van het vers gebakken brood zal worden genoten.
Gas druk
Men zou kunnen geloven dat door zo verspreid te zijn en de gasbollen of deeltjes te scheiden, deze niet in staat zijn om enige druk op lichamen of objecten te genereren. De atmosfeer toont echter aan dat een dergelijk geloof onjuist is: het heeft een massa, weegt en voorkomt dat vloeistoffen niet verdampt of kookt van niets. Kookpunten worden gemeten bij atmosferische druk.
Gasedrukken worden meer kwantificeerbaar als manometers beschikbaar zijn, of als ze worden opgesloten van niet -definiërende wandcontainers. Dus, hoe meer gasdeeltjes er in de container zijn, hoe groter het aantal botsingen tussen hen en de wanden van hetzelfde.
Deze deeltjes drukken bij het botsen met de wanden ze, terwijl ze op hun oppervlak een kracht uitoefenen die evenredig is aan hun kinetische energie. Het is alsof de ideale biljartballen tegen een muur overweldigd zijn; Als er veel van invloed zijn op hen met hoge snelheid, kan dit doorbreken.
Eenheden
Er zijn veel eenheden die gepaard gaan met de drukmetingen van een gas. Enkele van de bekendste zijn de millimeters van Mercurius (MMHG), evenals de Torr. Zijn die van het internationale systeem van eenheden (SI) die de Pascal (PA) definiëren in termen van N/M2; En van hem, de kilo (kpa), mega (mpa) en giga (gpa) pascal.
Gasvolume
Een gas bezet en breidt zich uit over het volume van de container. Hoe groter de container, het volume gas zal ook zijn; Maar zowel hun druk als hun dichtheid zullen afnemen voor dezelfde hoeveelheid deeltjes.
Het gas zelf heeft daarentegen een bijbehorend volume dat niet zoveel afhangt van zijn moleculaire aard of structuur (idealiter), maar van de druk- en temperatuuromstandigheden die het regelen; Dit is het molaire volume.
In werkelijkheid varieert het molaire volume van het ene gas tot het andere, hoewel de variaties klein zijn als ze niet van heterogene en grote moleculen zijn. Bijvoorbeeld het molaire volume ammoniak (NH3, 22.079 l/mol) bij 0 ºC en 1 atm, het verschilt van helium (hij, 22.435 l/mol).
Alle gassen hebben een molaire volume dat verandert afhankelijk van P en T, en ongeacht hoe groot hun deeltjes zijn, het aantal is altijd hetzelfde. Vanaf hier heeft hij afgeleid wat bekend is onder het Avogadro -nummer (nNAAR)).
Belangrijkste wetten van gassen
Gasegedrag bestudeert sinds de afgelopen eeuwen door experimenten, diepe observaties en interpretatie van de resultaten.
Dergelijke experimenten maakten een reeks wetten mogelijk die, verzameld in dezelfde vergelijking (die van ideale gassen), de reacties van een gas op verschillende druk- en temperatuuromstandigheden helpen voorspellen. Op deze manier is er een verband tussen het volume, temperatuur en druk, evenals het aantal van hun moedervlekken in een bepaald systeem.
Onder deze wetten zijn de volgende vier: Boyle, Charles, Gay-Lussac en Avogadro.
Boyle Law
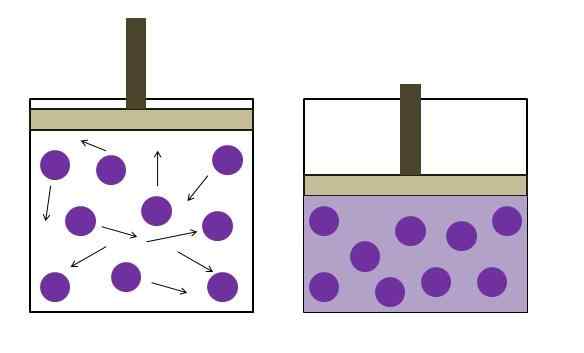 Verhoogde drukreductiedruk. Bron: Gabriel Bolívar
Verhoogde drukreductiedruk. Bron: Gabriel Bolívar De wet van Boyle stelt vast dat het volume van een ideaal gas bij constante temperatuur omgekeerd evenredig is met de druk; Dit is, hoe groter de container, hoe lager de druk die de wanden zullen ervaren met dezelfde hoeveelheid gas zal ervaren.
Het kan u van dienst zijn: Charles Law: Formules en eenheden, experimenteren, oefeningenCharles Law
 Chinese lantaarns of wensen. Bron: Pxhere.
Chinese lantaarns of wensen. Bron: Pxhere. De wet van Charles stelt vast dat het volume van een ideaal gas bij constante druk recht evenredig is met de temperatuur. De ballonnen demonstreren Charles '.
Gay-Lussac Law
De wet van Gay-Lussac stelt vast dat de druk van een ideaal gas bij constant volume recht evenredig is met de temperatuur. In een goed gesloten ketel als een gas geleidelijk opwarmt, zal elke keer de druk binnen groter zijn, omdat de wanden van de ketel niet misvormen of verwijden; Dat wil zeggen, het volume verandert niet, het is constant.
Avogadro Law
Ten slotte stelt de wet van Avogadro vast dat het volume bezet door een ideaal gas recht evenredig is met het aantal deeltjes. Het is dus als je een mol deeltjes hebt (6.02 · 1023), dan zal het molaire gasvolume zijn.
Soorten gassen
Brandbare gassen
Dit zijn gassen waarvan de componenten fungeren als brandstoffen, omdat ze worden gebruikt voor de productie van thermische energie. Sommigen van hen zijn aardgas, vloeibaar olie- en waterstofgas.
Industriële gassen
Dit zijn vervaardigde gassen, die aan het publiek worden verkocht voor verschillende toepassingen en toepassingen, zoals voor gezondheidssectoren, voedsel, milieubescherming, metallurgie, chemische industrie, beveiliging, onder andere. Sommige van deze gassen zijn onder andere zuurstof, stikstof, helium, chloor, waterstof, koolmonoxide, propaan, methaan, stikstofoxide, onder andere.
Inerte gassen
Het zijn die gassen die onder specifieke temperatuur- en drukomstandigheden geen chemische reactie of een zeer laag genereren. Zij zijn de neon, argon, helium, Kripton en Xenon. Ze worden gebruikt in chemische processen waarin niet -reactieve elementen nodig zijn.
Voorbeelden van gasvormige elementen en verbindingen
Wat zijn de gasvormige elementen van het periodiek systeem onder terrestrische omstandigheden?
We hebben eerst waterstof (H), die H -moleculen vormt2. Het wordt gevolgd door helium (hij), het lichtere edelgas; en dan stikstof (N), zuurstof (O) en fluoride (F). Deze laatste drie vormen ook diatomaire moleculen: n2, OF2 en f2.
Na fluoride komt de neon (NE), het edelgas dat het helium volgt. Onder fluor hebben we chloor (CL), in de vorm van CL -moleculen2.
Dan hebben we de rest van de edelgassen: Argon (AR), Kripton (KR), Xenón (XE), Radon (RN) en Oganeson (OG).
Daarom zijn het in totaal twaalf gasvormige elementen; elf als we de zeer radioactieve en onstabiele Oganeson uitsluiten.
Gasvormige verbindingen
Naast gasvormige elementen zullen enkele veel voorkomende gasvormige verbindingen worden vermeld:
-H2S, waterstofsulfide, verantwoordelijk voor de geur van rotte eieren
-NH3, ammoniak, dat penetrerende aroma dat wordt waargenomen in gebruikte zeep
-CO2, Koolstofdioxide, een broeikasgas
-NEE2, stikstofdioxide
-Nee, stikstofmonoxide, een gas dat extreem giftig werd verondersteld maar een belangrijke rol speelt in het bloedsomloop
-SW3, Zwaveltrioxide
-C4H10, butaan
-HCL, waterstofchloride
-OF3, ozon
-SF6, Hexafluoruro van zwavel
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- De eigenschappen van gassen. Opgehaald uit: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Gas. Opgehaald uit: in.Wikipedia.borg
- Helmestine, Anne Marie, pH.D. (5 december 2018). Gassen - Algemene eigenschappen van gassen. Hersteld van: Thoughtco.com
- Harvard Men's Health Watch. (2019). De staat van gas. Hersteld van: gezondheid.Harvard.Edu
- Elektronica -koeleditors. (1 september 1998). De thermische geleidbaarheid van gassen. Hersteld van: elektronica-koeling.com
- « Demonologiegeschiedenis, welke studie en beroemde demonologen
- Grafische nieuwe kenmerken, elementen, voorbeelden »

