Van der Waals Forces
- 2219
- 663
- Dr. Rickey Hudson
We leggen uit wat van der Waals de krachten, hun kenmerken, soorten zijn en geven voorbeelden in elk
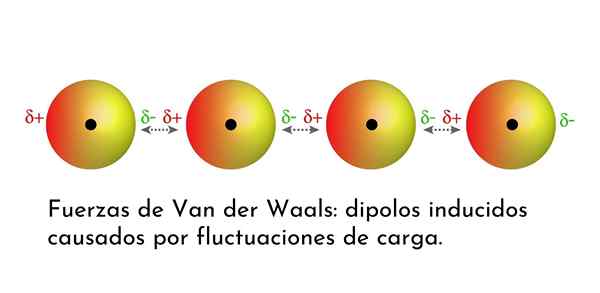
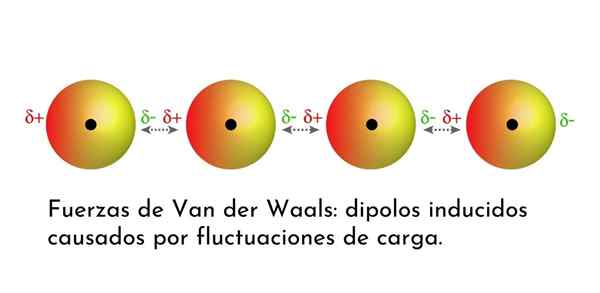 Illustratie die een van de soorten krachten van Van der Waals toont, de dispersiekrachten van Londen, onder verschillende atomen met onmiddellijke dipool
Illustratie die een van de soorten krachten van Van der Waals toont, de dispersiekrachten van Londen, onder verschillende atomen met onmiddellijke dipool Wat zijn de strijdkrachten van van der Waals?
De Van der Waals Forces Ze zijn een set korte -range aantrekkingskrachten tussen alle atomen en moleculen. Ze ontvangen hun naam ter ere van de Nederlandse wetenschapper Johannes Diderik van der Waals.
Deze krachten zijn relatief zwak, maar verschijnen op het gehele contactoppervlak tussen twee atomen, tussen twee moleculen of tussen twee oppervlakken, dus als het genoemde contactoppervlak groot is, kunnen de krachten van Van der Waals aanzienlijk worden.
Het begrip van de krachten van Van der Waals maakt het mogelijk om kwalitatief veel fysieke eigenschappen van chemische stoffen te voorspellen, zoals hun smelt- en kookpunten en oplosbaarheid in verschillende soorten oplosmiddelen. Dit zijn de krachten die toestaan om uit te leggen hoe het mogelijk is dat een monoatomisch gas zoals helium, dat geen enkele vorm van chemische binding vormt, kan condenseren en naar de vloeibare toestand kunnen gaan.
Deze krachten verklaren ook waarom een stof zoals water, die wordt gevormd door moleculen waarvan de molmassa slechts 18 g/mol is, vloeibaar is, terwijl chloor, dat bijna 4 keer meer weegt, een gas is bij kamertemperatuur.
Kenmerken van van der Waals Forces
Naast het weergeven van een type aantrekkingskracht tussen atomen en moleculen, delen de krachten van Van der Waals niet veel kenmerken met chemische bindingen. Vervolgens worden de meest opvallende kenmerken van dit type krachten gepresenteerd:
- Het zijn krachten die afhankelijk zijn van de afstand. In het eenvoudigste geval nemen ze af met het kwadraat van de afstand. Bovendien zijn ze sterk afhankelijk van moleculaire geometrie.
- Vergeleken met de aantrekkingskrachten die optreden in ionische, covalente en metaalachtige banden, zijn de krachten van Van der Waals relatief zwak.
- Met uitzondering van dipool-dipolo-interacties zijn het onafhankelijke temperatuurinteracties.
- Het zijn korte -range krachten, wat betekent dat ze snel afnemen als atomen en moleculen weggaan.
- Het zijn algemene krachten die optreden tussen elk atoom en een molecuul.
- In tegenstelling tot covalente bindingen hebben ze geen directionaliteit. Dit betekent dat, ongeacht de oriëntatie waarmee twee moleculen naderen, als ze voldoende naderen, de krachten van Van der Waals altijd zullen verschijnen.
- Wanneer twee moleculen of atomen te veel naderen, wordt de kracht weerzinwekkend, waardoor de moleculen elkaar niet instorten.
- Ze zijn additief, wat betekent dat, ondanks dat het aanzienlijk zwak is, het bestaan van veel gelijktijdige interacties ertoe kan leiden dat de totale aantrekkingskracht aanzienlijk is.
Soorten van der Waals -krachten
Naast de weerzinwekkende component die ervoor zorgt dat atomen en moleculen niet instorten, zijn er drie soorten van der Waals -krachten, die al dan niet tegelijkertijd kunnen werken tussen twee moleculen of atomen. Deze worden hieronder gepresenteerd:
1. Dipolo-Dipolo-interacties of Keesom-krachten
Keesom's kracht is een van de belastingbetalers van de kracht van van der Waals. Dit zijn de elektrostatische interactiekrachten die verschijnen tussen de permanente dipolen van de polaire moleculen zoals water, aceton en anderen.
De krachten van Keesom zijn vergelijkbaar met elektrostatische krachten tussen ionen, maar verschilt van deze in die zin dat ze veel zwakker zijn en vervallen met de zesde kracht van afstand (dat wil zeggen met r6)). De reden waarom ze zwakker zijn, is dat de aantrekkingskracht optreedt tussen de gedeeltelijke belastingen van een dipool, in plaats van hele elektrische ladingen zoals in het geval van ionen.
Deze interacties worden alleen gegeven tussen moleculen en niet tussen atomen, omdat atomen geen permanente dipoolmomenten hebben. Bovendien is de kracht van Keesom omgekeerd evenredig met de temperatuur, wat betekent dat, wanneer het toeneemt, de kracht van Keesom afneemt.
Voorbeelden van moleculen met dipool-dipolo-interacties
Alle polaire moleculen hebben dipool-dipool interacties daartussen. Bijvoorbeeld:
- Twee acetonmoleculen.
- Twee chloroformmoleculen.
- Een cyclohexanonmolecuul met een acetonmolecuul.
2. Geïnduceerde Dipolo-Dipolo-interacties of Debye-krachten
Wanneer een polair molecuul een atoom of een apolair molecuul nadert, trekt de dipool van de eerste elektronen op het oppervlak van de tweede aan of herhaalt. Dit induceert een dipool in het apolaire molecuul, dat geïnduceerde dipool wordt genoemd. De nieuwe dipool vormde en interageert vervolgens met de oorspronkelijke dipool die een kleine aantrekkingskracht creëert.
Kan u van dienst zijn: verbrandingwarmteDeze interacties tussen een permanente en geïnduceerde dipool worden meestal bekend als Debye -krachten en zijn niet alleen afhankelijk van de afstand tussen de twee moleculen of tussen het polaire molecuul en een individueel atoom, maar zijn ook afhankelijk van de polariseerbaarheid van het apolaire molecuul en van de magnitude en van de magnitude van het dipoolmoment van het polaire molecuul.
Voorbeelden van moleculen die dipool-dipool interacties hebben geïnduceerd
Dit soort interacties wordt alleen gegeven tussen verschillende moleculen, omdat de ene polair moet zijn en dat de andere dat niet doet. Enkele voorbeelden zijn:
- Een atoom van een edelgas zoals argon en een polaire verbinding zoals waterstofchloride. In dit geval trekt de positieve gedeeltelijke belasting in HCl -waterstof de Valencia -elektronen van argon aan, waardoor een klein dipol wordt geïnduceerd in de laatste. Als een argon het chlooratoom nadert, zal de negatieve gedeeltelijke belasting de valentie -elektronen afstoten en wordt er ook een geïnduceerde dipool gevormd.
- De moleculaire brominaat (Br2) Het is aanzienlijk oplosbaar in water, ondanks dat het een apolaire verbinding is en het water van een sterk polair oplosmiddel. De verklaring is gedeeltelijk te wijten aan de hoge polariseerbaarheid van de broom waarmee u aanzienlijk sterke interacties kunt vormen.
3. Geïnduceerde Dipolo-Dipolo geïnduceerde interacties of Londense dispersiekrachten
Van alle troepen van van der Waals zijn de zwakste de dispersiekrachten van Londen. Deze interacties worden gegeven tussen alle atomen en moleculen vanwege het verschijnen van onmiddellijke dipolen in een deel van hun structuur.
Een onmiddellijke dipool is een kleine dipool die wordt gevormd door een asymmetrische verdeling van valentie -elektronen op een bepaald moment.
Kan u van dienst zijn: onverzadigde koolwaterstoffenHoe worden instant dipolen gegenereerd?
Aangezien elektronen rond de kern draaien, kan het gebeuren dat er ooit meer elektronen aan de ene kant zijn dan van de andere, wat aanleiding geeft tot een dipool. Deze kleine dipool verdwijnt snel terwijl elektronen zich rond de kern blijven verplaatsen, en daarom worden ze snapshots genoemd.
Directe dipolen kunnen overal in de structuur van een molecuul ontstaan en op elk moment kunnen er veel zijn. Londense dispersiekrachten bestaan uit de interactie tussen deze instant tijden in het ene molecuul en die van een ander.
Voorbeelden van verbindingen met dispersiekrachten in Londen
Zoals vermeld, komen dit soort interacties op tussen alle atomen en moleculen. Het zit echter in de grote apolaire moleculen waar het effect ervan beter kan worden waargenomen, omdat het in deze gevallen het enige type intermoleculaire interactie is dat optreedt.
Een typisch voorbeeld waarin deze krachten zeer intens zijn, is in het geval van alifatische koolwaterstoffen met lange ketens, vooral bij polymeren zoals polyethyleen.

