Structuur blik, eigenschappen, het verkrijgen, gebruiken

- 4002
- 364
- Pete Heaney V
Hij blik Het is een metaal dat bij het blok hoort P van het periodiek systeem, waarvan het chemische symbool SN is, en die zich bevindt in groep 14, de koolstof. Ondanks dat het sinds de oudheid een veelgebruikt metaal is in de hele mensheid, is de waarheid dat het een schaars metaal is in de aardkorst (2.3 ppm).
Het is een zilveren, zacht, ductiel en kneedbaar metaal. Het heeft een atoomnummer van 50, en de overheersende toestanden of oxidatienummers zijn +2 (SN2+) en +4 (sn4+), Zijnde de verbindingen van tin (ii), zoals de SNCL2, Goede reductiemiddelen.
 Tin Alotropes. Bron: Zinn_9.Jpg: van: gebruiker: tomihahndorf.Derivative Work: MaterialScientist/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/2.0)
Tin Alotropes. Bron: Zinn_9.Jpg: van: gebruiker: tomihahndorf.Derivative Work: MaterialScientist/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/2.0) Het blik heeft als symbool SN, wat een afkorting is van het Latijnse woord "Stannum". Tin is een metaalbestendig tegen wateraanval en lucht bij kamertemperatuur; Maar in hete lucht vormt tindioxide, snam2.
Het eigendom van resistent tegen corrosie en een laag smeltpunt hebben, heeft gediend om talloze toepassingen te hebben; zoals de coating van metalen oppervlakken en lassen.
Het tin heeft twee belangrijkste allotrope vormen: de witte en vaste β -vorm; en de α, grijze en normaal stoffige contexten (broscher). Daarom is de β -vorm het meest gebruikt in tin -toepassingen.
Een ander belangrijk eigendom van tin is het vermogen om deel uit te maken van legeringen met verschillende metalen, de oudste is brons, een legering van koper en tin.
[TOC]
Ontdekking
 Tinnen korrels. Bron: Nephronus, CC0, via Wikimedia Commons
Tinnen korrels. Bron: Nephronus, CC0, via Wikimedia Commons Tin is een metaal dat sinds de oudheid bekend is. Daarom is het niet bekend wie zijn ontdekker was; En veel minder, het jaar en de plaats van zijn ontdekking.
Bronze is een legering van koper met tin en arseen. Het is mogelijk dat de uitwerking van deze legering een gevolg is van een toevallig en onbedoeld feit, omdat de eerste bronzen objecten - in de bronstijd - werden gevormd door koper en alleen arseensporen.
Deze objecten verschenen in het Nabije Oosten waar arseen wordt geassocieerd met koper. Maar vanaf het begin werd de toxiciteit van het arseen aangetoond, waardoor zijn vervanging werd bereikt2)).
De oude Grieken verkregen tin door maritieme handel en verwezen naar de bron van hun blik als "de cassiterides", wat 'tinnen eilanden' betekent. Het is mogelijk dat deze eilanden zich in Cornuelles, Brits of Spanje bevinden, waar grote tinafzettingen zijn.
Het kan u van dienst zijn: Bismuth -subsalicylaat: structuur, eigenschappen, gebruik, effectenChemische blikstructuur
Wanneer er twee alotropen zijn: de witte blik of β-Sn en het grijze blik of α-Sn, zullen we twee kristallijne structuren hebben. De β-Sn is tetragonaal gecentreerd op het lichaam (BCT), die de kneedbaarheid van het witte blik kenmerkt.
Ondertussen is de structuur van de a-Sn diamant; dat wil zeggen, de SN -atomen zijn verbonden met het vormen van tetrahedra netten, zonder het bestaan van een metalen binding.
Het blik presenteert ook twee andere alotropen onder verschillende drukomstandigheden (in de volgorde van de GPA) en temperatuur (boven 161 ºC): σ-Sn en γ-Sn.
Elektronische configuratie
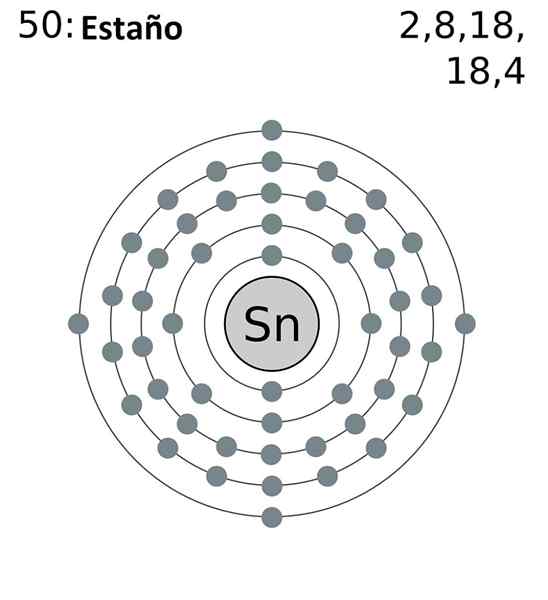
De afgekort elektronische configuratie is als volgt:
[KR] 4D10 5s2 5 p2
Door alle elektronen toe te voegen, hebben we in totaal 14, hetzelfde aantal dat overeenkomt met uw groep. Alleen de elektronen van de 5s en 5p -orbitalen zijn echter die welke deelnemen aan de chemische reacties van het TIN, omdat die van de 4D niet energetisch beschikbaar zijn.
Tin -eigenschappen
Uiterlijk en fysieke kenmerken
Tin is een zacht, ductiel en kneedbaar metaal, dat koud en spinnen kan zijn. Het lage smeltpunt maakt het mogelijk om zich te hechten aan reinige oppervlakken van metalen of legeringen zoals staal, koper en zijn legeringen, waardoor ze worden beschermd tegen oxidatie.
Wanneer een tinnen stuk wordt gevouwen, snijdt het en straalt een karakteristiek geluid uit dat bekend staat als de "tin schreeuw", een gevolg van het verpletteren van de kristallen.
Tin heeft twee allotrope vormen: β en α. De β -vorm komt overeen met een witte vaste stof en is verantwoordelijk voor tin -toepassingen; Terwijl de α -vorm een grijsachtig poeder is.
 Tin -locatie in het periodiek systeem. Bron: Afbeelding door Daniel Mayer of Greatpatton en uitgebracht onder de voorwaarden van de GNU FDL
Tin -locatie in het periodiek systeem. Bron: Afbeelding door Daniel Mayer of Greatpatton en uitgebracht onder de voorwaarden van de GNU FDL De β -vorm wordt gepresenteerd bij temperaturen boven 13.2 ºC. Wanneer de temperatuur daalt 13.2 ºC, Tin verandert van β -vorm naar de α -vorm. Dit fenomeen is ongewenst en wordt vermeden door andere metalen toe te voegen aan tin, zoals antimoon of bismut, die deze verandering blokkeren en de nuttige levensduur ervan verlengen.
Tin is de eerste supergeleider die bekend is bij temperaturen onder 3.72 K.
Atoomnummer
vijftig
Molaire massa
118.71 g/mol
Smeltpunt
231.93 ºC
Kookpunt
2602 ºC
Dikte
Alotropo β: 7.265 g/cm3
Alotropo α: 5.769 g/cm3
Oxidatietoestanden
Tin heeft meerdere oxidatietoestanden: -4, -3, -2, -1, 0, +1, +2, +3, +4. De meeste van hun verbindingen hebben echter het blik met oxidatietoestanden +2 (SN2+) en +4 (sn4+)).
Kan u van dienst zijn: organische verbindingenIonisatie -energieën
Eerst: 708.6 kJ/mol
Ten tweede: 1411.8 kJ/mol
Derde: 2943.0 kJ/mol
Elektronegativiteit
1.96 op de Pauling -schaal
Reactiviteit
Tin is een metaalbestendig tegen lucht- en wateractie bij kamertemperatuur, maar wanneer het in de lucht wordt verwarmd, vormt Tinoxide (IV), snam2, die zwak zuur is. Het wordt aangevallen door zuren en alkalis, en in aanwezigheid van zuurstof kan in sommige gevallen als katalysator fungeren.
Het verkrijgen van
 Casiterite mineraal is de hoofdtin mineralogische bron. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0)
Casiterite mineraal is de hoofdtin mineralogische bron. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0) Het blik, vanuit het oogpunt van het voorkomen, is een zeldzaam metaal, omdat het een overvloed heeft in de aardeschors van slechts 2 ppm. Casiterite mineraal, een tinoxide -mineraal, is de enige tinnen commerciële bron.
Het casiteriet is een zwartachtig mineraal gevonden op modderig terrein aan de oevers van de rivieren. Het blik wordt uit het casiteriet geëxtraheerd door tot 1370 ºC te verwarmen met kolen of cola om zijn reductie te produceren.
Het geproduceerde blik is onzuiver, dus wordt het behandeld met natriumhydroxide of zoutzuur om tin op te lossen. Dan wordt dit onderworpen aan elektrolyse, als de tinanode en de ijzeren kathode. Het blik wordt afgezet op de kathode, met een zuiverheid groter dan 90%.
Gebruik/toepassingen
Bescherming tegen corrosie
Tin is corrosiebestendig metaal. De zo -gevallen blikje of tin is een stalen container, bedekt met een tinlaag om oxidatie te voorkomen.
De blikken zijn gebruikt om voedsel en andere stoffen op te slaan, bijvoorbeeld: schilderijen, lakken, oplosmiddelen, enz. Maar ze worden momenteel vervangen door aluminium of plastic containers. Tincoated pijpen en kleppen behouden water en drinkzuiverheid.
Legeringen
 Het eerste gebruik voor tinlegeringen was het produceren van containers of gebruiksvoorwerpen zoals blikken en kannen van deze voorraadkast. Bron: Butterfly Voyages - Serge Ouachée/CC door -sa (https: // creativeCommons.Org/licenties/by-sa/3.0)
Het eerste gebruik voor tinlegeringen was het produceren van containers of gebruiksvoorwerpen zoals blikken en kannen van deze voorraadkast. Bron: Butterfly Voyages - Serge Ouachée/CC door -sa (https: // creativeCommons.Org/licenties/by-sa/3.0) De man begon meer dan 5000 jaar brons te gebruiken. Bronze is een legering van koper en blik die wordt gebruikt bij de uitwerking van gereedschappen, wapens, huishoudelijke gebruiksvoorwerpen.
Op dezelfde manier werd de schil, een legering die aanvankelijk van tin en lood was, gebruikt om potten, platen, enz. Maar vanwege loodtoxiciteit wordt Peel momenteel vervaardigd met tin-, antimoon- en kobaltlegering.
Het kan u van dienst zijn: HYPOYODOUS AUR (HIO)De tin- en loodlegering heeft een laag smeltpunt, eigendom dat het gebruik ervan in lassen heeft toegestaan, een techniek die dient om stukken in elektrische en elektronische circuits samen te stellen. Er zijn auto's waarin het blik legering is met ijzer, terwijl ze worden gebruikt in aluminium-, tin- en titaniumlegeringen in ruimtevaartvoertuigen.
Circoniumlegeringen, ook wel zirkaloys genoemd, worden gebruikt in kernreactoren en hebben een kleine hoeveelheid tin.
 Tinnen monsters. Bron: Ondřej Mangl, Public Domain, via Wikimedia Commons
Tinnen monsters. Bron: Ondřej Mangl, Public Domain, via Wikimedia Commons De legering van zilver en tin is gebruikt in tandheelkundige amalgamen.
Een kristallijne legering met het niobio -element is een supergeleider die bij een temperatuur van 18 K werkt en zijn eigenschap in een sterk magnetisch veld onderhoudt.
Glas
Het blik wordt gebruikt in de Pilkington -procedure om raamglas te produceren. Het gesmolten glas wordt op een gesmolten blikoppervlak geplaatst, waardoor het glas een plat en glad oppervlak wordt gekregen. Deze techniek wordt nog steeds met succes gebruikt.
Tinnen zouten worden op het glas gespoten om een geleidende stroomvoering te verkrijgen, kunnen kunnen gebruiken om verlichtingspanelen en voorruit te maken zonder vorst.
Tinverbindingen
Zondig chloride (sncl2) Het wordt gebruikt in gegalvaniseerd tin en als een reductiemiddel bij de productie van polymeren en kleurstoffen. Tin fluoride (SNF2) Het is een actief ingrediënt in tandheelkundige pasta's.
Ondertussen is het oxide een nuttige katalysator in bepaalde industriële processen. Bovendien wordt het gebruikt als poeder om staal te polijsten.
Organische blikverbindingen worden gebruikt als biociden en fungiciden, die giftig zijn voor mensen. Organische tinstabilisatoren worden gebruikt om veranderingen in polyvinylchloride te voorkomen als gevolg van blootstelling aan licht en warmte.
De chloride isñico (sncl4) wordt gebruikt als een parfumstabilisator en als uitgangsmateriaal voor andere tinnen zouten.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (vierde druk). MC Graw Hill.
- Wikipedia. (2020). Blik. Opgehaald uit: in.Wikipedia.borg
- National Center for Biotechnology Information (2020). Blik. PubChem Comunund Samenvatting voor CID 23974. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Dr. Doug Stewart. (2020). Tin Element Feiten. Hersteld van: chemicool.com
- De redacteuren van Enyclopaedia Britannica. (2020). Blik. Hersteld van: Britannica.com
- Bell, Terence. (26 augustus 2020). De eigenschappen, productie en toepassingen van tin. Hersteld van: Thoughtco.com
- Lentech B.V. (2020). Blik. Hersteld van: Lentech.com
- Stephanie Pupas. (28 juli 2015). Feiten over tin. Hersteld van: livescience.com
- AIP Conference Proceedings. (9 februari 2018). Tin Recovery van Tin Slak met behulp van elektrolysemethode. doen.org/10.1063/1.5024070

