Thermische evenwichtsvergelijkingen, toepassingen, oefeningen

- 4969
- 954
- Dewey Powlowski
De thermische balans van twee lichamen die in thermisch contact staan, is de toestand die na lang genoeg wordt bereikt, zodat de temperaturen van beide lichamen gelijk zijn aan.
In de thermodynamica wordt thermisch contact van twee lichamen (of twee thermodynamische systemen) opgevat als een situatie waarin de lichamen mechanisch contact hebben of worden gescheiden, maar in contact met een oppervlak dat alleen de warmtegaling van het ene lichaam naar het andere toestaat (diathermisch oppervlak (diathermisch oppervlak. )).
-
 Figuur 1. Na een tijdje zal het ijs en het drinken hun thermische balans bereiken. Bron: Pixabay
Figuur 1. Na een tijdje zal het ijs en het drinken hun thermische balans bereiken. Bron: Pixabay
In thermisch contact zou er geen chemische reactie moeten zijn tussen de systemen in contact. Er zou alleen warmte -uitwisseling moeten zijn.
Everyday situaties waarin er warmte -uitwisseling is, worden gepresenteerd met systemen zoals koud drankje en glas, hete koffie en theelepel, of lichaam en de thermometer, naast vele andere voorbeelden.
[TOC]
Wanneer twee of meer systemen in thermisch evenwicht zijn?
De tweede wet van de thermodynamica stelt vast dat warmte altijd van de hoogste temperatuurlichaam naar de laagste temperatuur gaat. Warmteoverdracht stopt zodra de temperaturen gelijk worden gemaakt en de thermische evenwichtsstatus wordt bereikt.
De praktische toepassing van thermisch evenwicht is de thermometer. Een thermometer is een apparaat dat zijn eigen temperatuur meet, maar dankzij de thermische balans kunnen we de temperatuur van andere lichamen kennen, zoals die van een persoon of dier.
De thermometer van de kwikkolom wordt in thermisch contact met het lichaam geplaatst, bijvoorbeeld onder de tong, en er wordt verwacht dat voldoende tijd de thermische balans tussen het lichaam en de thermometer zal bereiken en dat de lezing niet meer varieert.
Wanneer dit punt wordt bereikt, is de temperatuur van de thermometer hetzelfde als het lichaam.
De nulwet van de thermodynamica stelt vast dat als een lichaam A in thermisch evenwicht is met een lichaam C en datzelfde lichaam C zich in thermisch evenwicht met B bevindt, dan A en B in thermisch evenwicht zijn, zelfs wanneer tussen A en B er geen thermisch contact is.
We concluderen dat er twee of meer systemen in thermisch evenwicht zijn wanneer ze dezelfde temperatuur hebben.
Thermische evenwichtsvergelijkingen
We nemen een lichaam aan bij de initiële temperatuur in thermisch contact met een ander B -lichaam met initiële temperatuur TB. We gaan er ook van uit dat ta> tb, vervolgens volgens de tweede wet de hitte wordt overgedragen van A naar B.
Na een tijdje zal de thermische balans worden bereikt en beide lichamen hebben dezelfde eindtemperatuur TF. Dit heeft een tussenliggende waarde voor TA en TB, dat wil zeggen ta> tf> tb.
De hoeveelheid warmte overgebracht van A naar B is QA = ma ca (tf - ta), waarbij ma de massa van lichaam a is, ca de warmtecapaciteit per eenheid massa van een y (tf - ta) het temperatuurverschil. Als TF minder is dan dan is QA negatief, wat aangeeft dat het lichaam warmte geeft.
Evenzo voor lichaam B moet u QB = MB CB (tf - tb); En als TF groter is dan TB, is QB positief, wat aangeeft dat lichaam B warmte ontvangt. Aangezien lichaam A en B zich in thermisch contact tussen hen bevinden, maar geïsoleerd uit de omgeving, moet de totale hoeveelheid uitgewisselde warmte null zijn: QA + QB = 0
Dan ma ca (tf - ta) + mb cb (tf - tb) = 0
Evenwicht temperatuur
Het ontwikkelen van deze expressie en het opruimen van de TF -temperatuur wordt de uiteindelijke thermische evenwichtstemperatuur verkregen.
-
 Figuur 2. Eindbalanstemperatuur. Bron: zelf gemaakt
Figuur 2. Eindbalanstemperatuur. Bron: zelf gemaakt
Tf = (ma ca ta + mb cb tb) / (ma ca + mb cb).
Als een bepaald geval, overweeg het geval dat lichamen A en B identiek zijn in massa en in warmtecapaciteit, in dit geval zal de evenwichtstemperatuur zijn:
Tf = (ta + tb) / 2 ↔ als ma = mb en ca = cb.
Thermisch contact met faseverandering
In sommige situaties gebeurt het dat wanneer twee lichamen in thermisch contact worden geplaatst, de warmte -uitwisseling de verandering van toestand of fase in een van hen veroorzaakt. Als dit gebeurt, moet rekening worden gehouden dat er tijdens de faseverandering geen temperatuurverandering is in het lichaam dat zijn status wijzigt.
Als de faseverandering van een van de lichamen in thermisch contact optreedt, wordt het concept van latente warmte L toegepast, wat de energie is per massa -eenheid die nodig is voor de verandering van staat:
Q = l ∙ m
Bijvoorbeeld om 1 kg ijs bij 0 ° C te smelten, zijn 333,5 kJ/kg vereist en die waarde is de latente warmte van ijssmelten.
Tijdens de fusie wordt vast water veranderd in vloeibaar water, maar dat water handhaaft dezelfde ijstemperatuur tijdens het fusieproces.
Toepassingen
Thermisch evenwicht is onderdeel van het dagelijkse leven. Laten we bijvoorbeeld deze situatie in detail onderzoeken:
-Oefening 1
Een persoon wil baden met warm water bij 25 ° C. Plaats 3 liter koud water in een kubus op 15 ° C en in de keukenwarmte water tot 95 ° C.
Hoeveel liter heet water moet toevoegen aan de kubus met koud water om de gewenste eindtemperatuur te hebben?
Oplossing
Stel dat het koud water is en warm water:
-
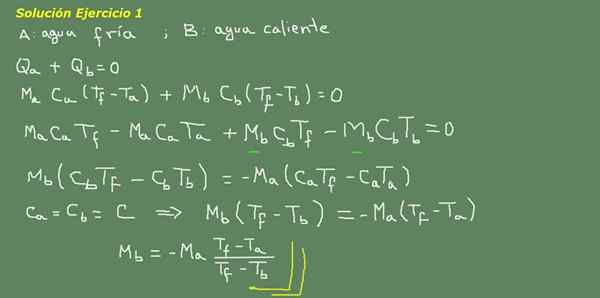 figuur 3. Oefening 3 Oplossing. Bron: zelf gemaakt.
figuur 3. Oefening 3 Oplossing. Bron: zelf gemaakt.
We stellen de thermische evenwichtsvergelijking voor, zoals aangegeven op de bord van figuur 3 en van daaruit wissen we het MB -water.
De initiële massa koud water kan worden verkregen omdat de dichtheid van het water bekend is, wat 1 kg is voor elke liter. Dat wil zeggen, we hebben 3 kg koud water.
Ma = 3 kg
Dus
Mb = - 3 kg*(25 ° C - 15 ° C)/(25 ° C - 95 ° C) = 0,43 kg
Dan is het voldoende met 0,43 LT's heet water om eindelijk 3,43 liter warm water te verkrijgen bij 25 ° C.
Opgeloste oefeningen
-Oefening 2
Een stuk metaal van 150 g massa wordt geïntroduceerd en met een temperatuur van 95 ° C tot een container die een halve liter water bevat bij een temperatuur van 18 ° C. Na een tijdje is de thermische balans en de temperatuur van het water en het metaal bereikt 25 ° C.
Stel dat de container met water- en metaalstuk een gesloten thermoskan is die geen warmte -uitwisseling met de omgeving mogelijk maakt.
Verkrijg de specifieke metaalwarmte.
Oplossing
Eerst zullen we de warmte berekenen die door water wordt geabsorbeerd:
Qa = ma ca (tf - ta)
Qa = 500 g 1cal/(g ° C) (25 ° C - 18 ° C) = 3500 calorieën.
Dat is dezelfde warmte gegeven door metaal:
Qm = 150 g cm (25 ° C - 95 ° C) = -3500 calorieën.
Dan kunnen we de warmtecapaciteit van het metaal verkrijgen:
Cm = 3500 cal/ (150 g 70 ° C) = ⅓ cal/ (g ° C).
Oefening 3
Je hebt 250 c.C. water bij 30 ° C. Aan dat water dat zich in een isolerende thermoskosten bevindt, worden 25 g ijsblokjes bij 0 ° C toegevoegd, met als doel het te koelen.
Bepaal de evenwichtstemperatuur; dat wil zeggen, de temperatuur die zal blijven zodra al het ijs is gesmolten en het ijswater is verwarmd tot het water dat aanvankelijk het glas had.
Oplossing 3
Deze oefening kan in drie fasen worden opgelost:
- De eerste is de fusie van ijs die warmte van het initiële water absorbeert om te smelten en water te worden.
- Vervolgens wordt de temperatuurdaling in het initiële water berekend, omdat het warmte heeft gegeven (QCED<0) para fundir el hielo.
- Ten slotte moet gesmolten water (van ijs) thermisch in balans zijn met het water dat aanvankelijk bestond.
-
 Figuur 4. Oefening 3 Oplossing. Bron: zelf gemaakt.
Figuur 4. Oefening 3 Oplossing. Bron: zelf gemaakt.
Laten we de warmte berekenen die nodig is voor de fusie van ijs:
Qf = l * mh = 333,5 kJ/kg * 0,025 kg = 8,338 kJ
Vervolgens is de door het water toegewezen warmte om het ijs te smelten QCED = -QF
Deze warmte die door het water wordt toegewezen, daalt zijn temperatuur af naar een t 'waarde die we als volgt kunnen berekenen:
T '= t0 - qf/(ma*ca) = 22.02 ° C
Waar CA de warmtecapaciteit van water is: 4,18 kJ/(kg ° C).
Eindelijk zal de oorspronkelijke massa water die zich nu bij 22,02 ° C bevindt warmte op het gesmolten water van het ijs dat op 0 ° C staat.
Ten slotte wordt de evenwichtstemperatuur na voldoende tijd bereikt:
Te = (ma * t ' + mh * 0 ° C) / (ma + mh) = (0,25 kg * 22,02 ° C + 0,025 kg * 0 ° C) / (0,25 kg + 0,025kg).
Eindelijk de evenwichtstemperatuur verkrijgen:
TE = 20.02 ° C.
-Oefening 4
Een loodstuk van 0,5 kg verlaat de oven bij een temperatuur van 150 ° C, wat vrij onder het smeltpunt ligt. Dat stuk wordt in een container geplaatst met 3 liter water bij kamertemperatuur van 20 ° C. Bepaal de uiteindelijke evenwichtstemperatuur.
Ook berekenen:
- Hoeveelheid warmte geleverd door lood naar water.
- Hoeveelheid warmte geabsorbeerd door water.
Gegevens:
Specifieke loodwarmte: CP = 0,03 limoen/(G ° C); Specifieke waterwarmte: Ca = 1 limoen/(G ° C).
Oplossing
In de eerste plaats bepalen we de uiteindelijke evenwichtstemperatuur TE:
Te = (ma ca ta + mp cp tp) / (ma ca + mp cp)
TE = 20,65 ° C
Dan is de hoeveelheid warmte toegewezen door lead:
Qp = mp cp (te - tp) = -1,94 x 10³ limoen.
De hoeveelheid warmte die wordt opgenomen door water zal zijn:
Qa = ma ca (te - ta) = +1,94x 10³ limoen.
Referenties
- Atkins, P. 199999. Fysische chemie. Omega -edities.
- Bauer, W. 2011. Fysica voor engineering en wetenschappen. Deel 1. MC Graw Hill.
- Giancoli, D. 2006. Fysica: principes met toepassingen. 6e ... Ed Prentice Hall.
- Hewitt, Paul. 2012. Conceptuele fysieke wetenschap. 5e. ED. Pearson.
- Resnick, r. (1999). Fysiek. Vol. 1. 3e ed. in het Spaans. Continental Editorial Company s.NAAR. van C.V.
- Rex, a. 2011. Fundamentals of Physics. Pearson.
- Sears, Zemansky. 2016. Universitaire natuurkunde met moderne natuurkunde. 14e. ED. Deel 1.
- Serway, r., Jewett, J. (2008). Natuurkunde voor wetenschap en engineering. Deel 1. 7e. ED. Cengage leren.
- « Continu -kenmerken van het productiesysteem, voordelen, voorbeelden
- Ecuador liberale revolutie oorzaken, ontwikkeling en gevolgen »

