Enthalpía
- 1984
- 319
- Aaron Okuneva
Wat is enthalpie?
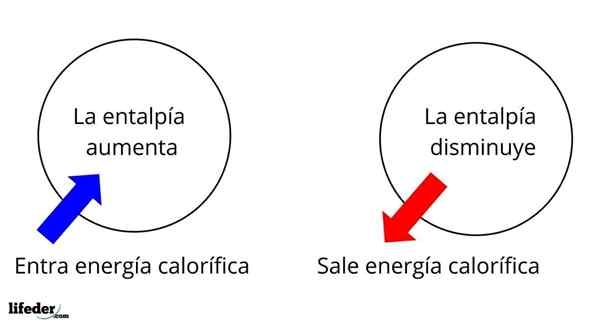
De enthalpía Het is een thermodynamische eigenschap waarvan de variatie, onder constante temperatuur- en drukomstandigheden, de calorie -energie van een stof of systeem bepaalt geassocieerd met een chemische reactie of fysiek proces. Als een staatsfunctie wordt het weergegeven met de letter in kapitaal H, en is Δh zijn variatie.
Het is een van de meest fundamentele uitgebreide eigenschappen om de thermochemie van vele reacties te bestuderen; dat wil zeggen, we praten over het onthechting of de absorptie van warmte tussen het medium van de reactie en de omgeving ervan. We zeggen dus dat een reactie exotherme is als de AH negatief is (ΔH 0).
 De verandering van enthalpie in het smelten van het ijs is positief, wat aangeeft dat het ijs warmte van de omgeving absorbeert om naar de vloeibare toestand te gaan, het water
De verandering van enthalpie in het smelten van het ijs is positief, wat aangeeft dat het ijs warmte van de omgeving absorbeert om naar de vloeibare toestand te gaan, het water IJs heeft bijvoorbeeld een enthalpie, hijs, Terwijl water ook zijn eigen enthalpie heeft, hwater. Wanneer het ijs smelt, treedt een enthalpie -variatie op, ΔH genoemdFus of smeltende warmte (hwater-Hijs)). Waterthalpie is superieur aan ijs en veroorzaakt ΔHFus Want het ijs is positief en heeft een +6 -waarde.01 kJ/mol.
Enthalpie en de variatie ervan worden meestal uitgedrukt in Joule- of calorie -eenheden. De verandering van enthalpie +6.01 kJ/mol geeft aan dat een ijsmol moet absorberen 6.01 kJ calorie -energie of warmte om te smelten.
Hoe wordt enthalpia berekend??
Enthalpie en zijn variatie
Enthalpy zelf is onberekenbaar, omdat het afhankelijk is van variabelen die moeilijk te meten zijn. Een goede vergelijking zou zijn om het totale volume van de oceanen te willen meten: er zullen er altijd delen van zijn onder de aarde of verspreid over de continenten. Daarom kan, en in de praktijk, h niet worden bepaald; Maar ja ΔH.
Kan u van dienst zijn: colloïdeOm een wiskundige uitdrukking te bereiken die de berekening van AH mogelijk maakt, moet deze eerst worden achtergelaten van de fundamentele definitie van enthalpie:
H = u + pv
De interne energie van het systeem of de substantie in kwestie zijn, en pv het druk-volumewerk dat dit systeem uitoefent op de omgeving om te bestaan. Omdat we geïnteresseerd zijn in het berekenen van AH en geen H, hebben we:
ΔH = Δu + δ (PV)
Als de druk constant is, blijft de vergelijking:
ΔH = Δu + pδv
We weten daarentegen dat:
Δu = Q + W
Wezen Q Warmte en W werk. Ons vervangen:
ΔH = Q + W + PAV
Maar bovendien weten we dat:
W = - PAV
En daarom:
ΔH = Q - Pδv + pδv
ΔH = Q
Dat wil zeggen dat de AH voor een reactie of proces, uitgevoerd onder constante druk, gelijk zal zijn aan warmte Q gegenereerd of geabsorbeerd.
Reacties enthalpie verandert
De veronderstelling dat de druk constant blijft, is mogelijk als de reactie optreedt onder de atmosfeer van de aarde. Het ijs van winterlandschappen smelt bijvoorbeeld zonder een andere druk te ervaren dan die van onze atmosfeer. Aan de andere kant is het ook van toepassing op reacties in vloeibare media, of die die geen grote hoeveelheden gassen produceren.
Deze reacties absorberen of geven warmte af Q gelijk aan ΔH, dat op zijn beurt het verschil is in enthalpieën tussen producten en reactanten:
ΔH = hProducten - HReactanten
Soorten enthalpie
Het is een gebruikelijke praktijk om over AH en H te praten alsof ze hetzelfde waren: beide worden enthalpieën genoemd. Als het gaat om de typen, is H echter uniek voor elke stof of systeem; Terwijl AH daarentegen onderhevig is aan de aard van de reactie of het proces op zichzelf.
In deze zin hebben we eerst positieve enthalpie -variaties (ΔH> 0) of negatief (ΔH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Het kan u van dienst zijn: nitrobenzeen (C6H5N2): structuur, eigenschappen, gebruik, risico'sHet teken '+' of '-' dat vergezelt, vertelt ons daarom als er bevrijding of absorptie van warmte is in een bepaalde reactie of proces; die hun AH -kenmerken hebben, als onderdeel van hun thermochemische eigenschappen.
We hebben oneindigheden van soorten enthalpieën, die kunnen worden geclassificeerd volgens fysieke processen of chemische reacties.
Fysieke processen
Faseverandering enthalpie
Stoffen moeten warmte absorberen of vrijgeven om van een materiaal- of materiaalfase (vaste, vloeistof of gas) naar een andere te verplaatsen. IJs absorbeert bijvoorbeeld warmte om te smelten, dus enthalpie voor deze faseverandering komt overeen met fusie, ΔHFus, ook wel latente warmtewarmte genoemd.
Enthalpie van ontbinding of mengsel
Stoffen wanneer opgelost of gemengd in een oplosmiddelmedium kan warmte absorberen of vrijgeven, dus met een enthalpie ΔHDis of ΔHMengen.
Chemische reacties
Training Enthalpy
Het is de bijbehorende warmte, ΔHºF, tot de vorming van een verbinding, met name één mol, van zijn samenstellende elementen in standaard omstandigheden van druk en temperatuur (t = 298.15 K en P = 1 ATM).
Ontleding enthalpie
Het is de bijbehorende warmte, ΔHdes, tot de afbraak van een verbinding in kleinere en eenvoudige stoffen. Het is over het algemeen positief, omdat warmte nodig is om de bindingen van de moleculen te verbreken.
Hydrogeneringstalpie
Het is de bijbehorende warmte, ΔHH, Aan de verslaving van een waterstofmolecuul op een verbinding, meestal een koolwaterstof.
Verbranding enthalpie
Het is de vrijgegeven warmte, ΔHkam, Wanneer een stof brandt met zuurstof. Het is negatief, omdat warmte en licht worden vrijgegeven (vuur).
Het kan u van dienst zijn: Atomic Mass: Definitie, Typen, hoe het te berekenen, voorbeeldenVoorbeelden van enthalpieën
Ten slotte zullen er een aantal specifieke voorbeelden van enthalpieën worden gemaakt:
Methaanverbranding
Ch4 + 22 → CO2 + 2h2OF
ΔH = -890.3 kJ/mol
Dat wil zeggen, één mol cho4 Wanneer verbranding 890 bevrijdt.3 kJ calorie -energie.
Hydrogenering van ethyleen
Ch2= Ch2 + H2 → ch3Ch3
ΔH = -136 kJ/mol
Een mol ethyleen geeft 136 kJ warmte vrij wanneer waterstof een ethaan wordt.
Zout in water
Tafelzout, NaCl, lost in het water op om de na -ionen te scheiden+ en Cl- van kristallijne netwerken en surround (hydraat) van watermoleculen:
NaCl (s) → NA+(AC) + Cl-(AC)
ΔH = +3.87 kJ/mol
Dat wil zeggen, het oplossen van zout in water, dienovereenkomstig om het glas of de container te koelen. De geabsorbeerde hoeveelheid warmte is echter erg klein, dus onze handen zullen slechts een lichte temperatuurverandering voelen.
Kalium chloraat oplossing in water
Aan de andere kant, het kaliumchloraat, KCLO3, Het heeft een ΔHDis heel positief:
KCL3(s) → K+(AC) + clo3-(AC)
ΔH = +41.38 kJ/mol
Wat betekent dat het om in het water op te lossen, het zeer heet absorbeert. En daarom zal de container aanzienlijk afkoelen en we zullen zien dat de omringende waterdamp zijn buitenoppervlak zal bevochtigen.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2020). Enthalpie. Opgehaald uit: in.Wikipedia.borg
- Helmestine, Anne Marie, pH.D. (28 augustus 2020). Enthalpy Definitie in chemie en natuurkunde. Hersteld van: Thoughtco.com
- Andrew Rader Studios. (2015). Energie en enthalpie. Hersteld van: Physics4Kids.com
- Visnet. (2020). Enthalpy Feiten voor kinderen. Opgehaald uit: feiten.Visnet.co
- beheerder. (21 december 2010). De enthalpie. Herkend uit: Oxyorganic Chemical.com
- María Estela Raffino. (11 juli 2020). Entalpia -concept. Hersteld van: concept.van

