PI -link
- 1346
- 67
- Dr. Rickey Hudson
We leggen uit wat de PI -link is, hoe de kenmerken worden gevormd en we geven verschillende voorbeelden
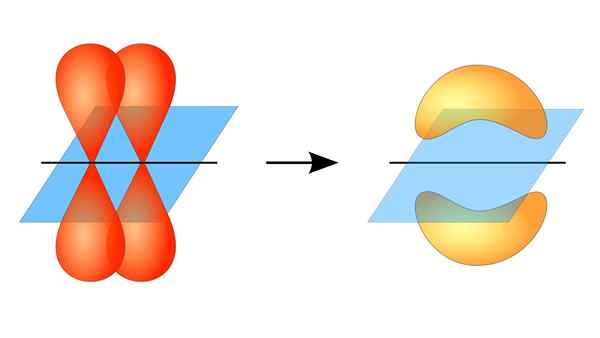
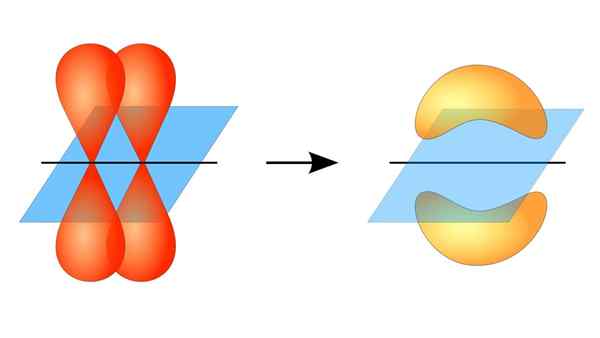 Twee orbitalen P vormen een link π
Twee orbitalen P vormen een link π Wat is een PI -link?
A PI -link (π) Het is een covalent type link dat wordt gekenmerkt door het voorkomen van de vrije rotatiebeweging van atomen en het ontstaan tussen een paar pure atoom orbitalen, onder andere eigenaardigheden. Er zijn links die kunnen worden gevormd tussen atomen door hun elektronen, waardoor ze grotere en complexere structuren kunnen bouwen: moleculen.
Deze links kunnen van verschillende variëteiten zijn, maar de meest voorkomende op dit gebied van studie zijn de covalent. De covalente bindingen, ook wel moleculair genoemd, zijn een type link waarbij de betrokken atomen elektronenparen delen.
Dit kan optreden als gevolg van de noodzaak van atomen om stabiliteit te zoeken, waardoor de meeste bekende verbindingen worden gevormd. In die zin kunnen covalente bindingen eenvoudig, dubbel of drievoudig zijn, afhankelijk van de configuratie van hun orbitalen en de hoeveelheid elektronenparen die worden gedeeld tussen de betrokken atomen.
Dit is de reden waarom er twee soorten covalente binding zijn die worden gevormd tussen atomen op basis van de oriëntatie van hun orbitalen: de Sigma (σ) links en de pi (π) links (π).
Het is belangrijk om beide links te differentiëren, omdat de Sigma -link wordt gepresenteerd in eenvoudige vakbonden en de PI in meerdere vakbonden tussen atomen (twee of meer elektronen worden gedeeld).
Hoe is de PI -link -formulieren?
Om de vorming van de PI -link te beschrijven, moet eerst worden besproken over het hybridisatieproces, omdat het in sommige belangrijke links tussenbeide komt.
Hybridisatie is een proces waarbij hybride elektronische orbitalen worden gevormd; dat wil zeggen, waar atomaire sub -level orbitalen S en P kunnen worden gemengd. Dit veroorzaakt de vorming van SP, SP Orbitals2 en sp3, die hybriden worden genoemd.
Kan u van dienst zijn: omkeerbare reactie: kenmerken en voorbeeldenIn deze zin treedt de vorming van de PI -banden voor dankzij de overlapping van een paar lobben die tot een atoom orbitaal behoren op een ander paar lobben die zich in een orbitaal bevinden dat deel uitmaakt van een ander atoom.
Deze orbitale overlapping vindt lateraal plaats, dus de elektronische verdeling is meestal geconcentreerd boven en onder het vlak dat de gekoppelde atoomkernen vormen, en zorgt ervoor dat de PI -bindingen zwakker zijn dan de Sigma -bindingen.
Bij het praten over de orbitale symmetrie van dit type unie, moet worden vermeld dat het gelijk is aan die van de p -orbitalen type P zolang het wordt waargenomen door de as gevormd door de link. Bovendien worden deze vakbonden meestal samengesteld door orbitalen P.
PI -bindingsvorming bij verschillende chemische soorten
Aangezien de PI -obligaties altijd gepaard gaan met een of twee meer links (één Sigma of een andere PI en één Sigma), is het relevant om te weten dat de dubbele binding die wordt gevormd tussen twee koolstofatomen (gevormd door een Sigma -binding en één PI) bezit lagere linkergie dan die welke overeenkomt met twee keer de Sigma -link tussen de twee.
Dit wordt verklaard door de stabiliteit van de Sigma -link, die groter is dan die van de PI -binding omdat de overlapping van atomaire orbitalen in de laatste parallel plaatsvindt in de gebieden boven en onder de lobben, waardoor de elektronische verdeling op verdere weg van atoom wordt verzameld. kernen.
Desondanks, wanneer PI- en Sigma -links een meervoudige luidere link worden gecombineerd dan de eenvoudige link op zichzelf, die kan worden geverifieerd door de linklengtes tussen verschillende atomen met eenvoudige en meerdere links te observeren.
Kan u van dienst zijn: niet -metalen oxidenEr zijn enkele chemische soorten die worden bestudeerd door hun uitzonderlijke gedrag, zoals coördinatieverbindingen met metaalelementen, waarin de centrale atomen alleen worden verenigd door PI -bindingen.
PI Link -kenmerken
Staat de vrije rotatiebeweging van atomen niet toe
De kenmerken die de PI -banden onderscheiden van andere soorten interacties tussen atoomsoorten worden hieronder beschreven, te beginnen met het feit dat deze unie de vrije rotatiebeweging van atomen, zoals koolstof, niet toestaat. Om deze reden, als er een rotatie van de atomen is, treedt de bindingsbreuk op.
Overlappen tussen orbitalen door twee parallelle regio's
Evenzo gebeurt in deze links de overlap tussen de orbitalen door twee parallelle regio's, waardoor ze een grotere diffusie hebben dan de Sigma -bindingen en dat ze om deze reden zwakker zijn.
Tussen een paar pure atoom orbitalen
Aan de andere kant, zoals hierboven vermeld, wordt de PI -link altijd gegenereerd tussen een paar pure atoomorbitalen; Dit middel wordt gegenereerd tussen orbitalen die geen hybridisatieprocessen hebben geleden, waarbij de dichtheid van elektronen meestal wordt geconcentreerd boven en onder het vlak gevormd door de covalente Unie.
In die zin kan meer dan één PI -link worden gepresenteerd onder een paar atomen, altijd vergezeld van een Sigma -link (in dubbele bindingen).

Evenzo kunt u een drievoudige link geven tussen twee aangrenzende atomen, die wordt gevormd door twee PI -bindingen in posities die loodrechte vlakken met elkaar vormen en een sigma -link tussen de twee atomen.
Kan u van dienst zijn: humuszuur: structuur, eigenschappen, verkrijgen, gebruikVoorbeelden van PI -links
Ethyleenmolecuul
Zoals eerder vermeld, hebben de moleculen die door verenigde atomen worden gevormd door een of meer PI -bindingen altijd meerdere links; dat wil zeggen, dubbel of drievoudig.
Een voorbeeld hiervan is het ethyleenmolecuul (h2C = Ch2), die wordt gevormd door een dubbele unie; Dat wil zeggen, een PI en één sigma -binding tussen zijn koolstofatomen, naast de sigma -bindingen tussen koolstofatomen en hydrogenen.
Acetyleenmolecuul
Van zijn kant heeft het acetyleenmolecuul (H-C≡C-H) een drievoudige link tussen zijn koolstofatomen; dat wil zeggen twee PI-bindingen die loodrechte vlakken en een sigma-binding vormen, naast de overeenkomstige koolstofhydrogene bindingen.
Benzeen en derivaten
PI -bindingen tussen cyclische moleculen worden ook gepresenteerd, zoals benzeen (C6H6) en zijn derivaten, waarvan de beschikking resulteert in een effect dat resonantie wordt genoemd, waardoor elektronische dichtheid mogelijk is om te migreren tussen atomen en onder andere, een grotere stabiliteit voor de verbinding.
Dicarbon
Om de eerder genoemde uitzonderingen te illustreren, de gevallen van het dicarbonale molecuul (C = C, waarin beide atomen een paar gepaarde elektronen hebben) en de coördinatieverbinding genaamd hexacarbonildihierro (weergegeven als geloof2(CO)6, die alleen wordt gevormd door PI -banden tussen zijn atomen).

