Polaire covalente linkkarakteristieken en voorbeelden
- 5015
- 255
- Lonnie Rohan
A Polaire covalente binding Het is dat gevormd tussen twee chemische elementen waarvan het verschil in elektronegativiteit aanzienlijk is, maar zonder een puur ionisch karakter te benaderen. Het is dus een tussenliggende sterke interactie tussen apolaire covalente bindingen en ionische links.
Er wordt gezegd dat het covalent is omdat er in theorie een billijke delen is van een elektronisch paar tussen de twee gekoppelde atomen; dat wil zeggen, de twee elektronen worden gelijk gedeeld. Het atoom e · doneert een elektron, terwijl · x het tweede elektron levert om de covalente binding e: x of e-x te vormen.
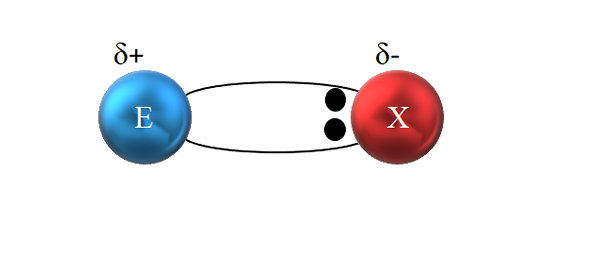
 In een polaire covalente binding wordt het paar elektronen niet billijk gedeeld. Bron: Gabriel Bolívar.
In een polaire covalente binding wordt het paar elektronen niet billijk gedeeld. Bron: Gabriel Bolívar. Zoals te zien in het superieure beeld, bevinden de twee elektronen zich echter niet in het midden van E en X, wat aangeeft dat ze "circuleren" met dezelfde frequentie tussen beide atomen; maar zijn dichter bij X dan E. Dit betekent dat X het paar elektronen tot zichzelf heeft aangetrokken vanwege de grotere elektronegativiteit.
Als de elektronen van de link dichter bij X dan E, rond x een gebied met een hoge elektronische dichtheid wordt gecreëerd, Δ-; Terwijl in E een slecht gebied in elektronen verschijnt, δ+. Daarom is er een polarisatie van elektrische ladingen: een polaire covalente binding.
[TOC]
Kenmerken
Polariteitsgraden
Covalente bindingen zijn zeer overvloedig van aard. Ze zijn praktisch aanwezig in alle heterogene moleculen en chemische verbindingen; Omdat het tenslotte wordt gevormd wanneer twee verschillende atomen E en X zijn gekoppeld. Er zijn echter meer polaire covalente bindingen dan andere, en om erachter te komen dat u toevlucht moet nemen tot elektronegativiteiten.
Hoeveel meer elektronegatief is x en minder elektronegatief e e (elektropositief), dan zal de resulterende covalente binding meer polair zijn. De conventionele modus om te schatten dat deze polariteit door de formule is:
Kan u dienen: natriumborohydride (NABH4): structuur, eigenschappen, gebruikχX - χEN
Waar χ de elektronegativiteit is van elk atoom volgens de Pauling -schaal.
Als deze aftrekken of aftrekken waarden heeft tussen 0,5 en 2, dan is het een polaire link. Daarom is het mogelijk om de mate van polariteit tussen verschillende E-X-links te vergelijken. In het geval dat de verkregen waarde hoger is dan 2, is er sprake van een ionische link, en+X- En dat is het nietδ+-Xδ-.
De polariteit van de E-X-link is echter niet absoluut, maar hangt af van moleculaire omgevingen; Dat wil zeggen, in een molecuul -e-x-, waarbij e en x covalente bindingen vormen met andere atomen, beïnvloedt de laatste direct die mate van polariteit.
Chemische elementen die hen ontstaan
Hoewel E en X elk element kunnen zijn, zijn niet alle afkomst van polaire covalente bindingen. Als E bijvoorbeeld een zeer elektropositief metaal is, zoals alkalisch (Li, NA, K, RB en CS) en X A halogeen (F, Cl, BR en I), zullen ze de neiging hebben om ionische verbindingen te vormen (NA+Klet-) en geen moleculen (Na-Cl).
Dat is de reden waarom polaire covalente bindingen meestal tussen twee niet -metalen elementen liggen; en in mindere mate, tussen niet -metalen elementen en enkele overgangsmetalen. Het blok zien P Uit het periodiek systeem zijn er veel opties om dit type chemische links te vormen.
Polair en ionisch karakter
In grote moleculen is het niet belangrijk om na te denken over hoe polair een link is; Deze zijn zeer covalent en de verdeling van hun elektrische ladingen (waar zijn de rijke of slechte regio's van elektronen) is meer aandacht om de mate van covalentie van hun interne banden te definiëren.
Kan u van dienst zijn: gaschromatografieMet diatomeeën of kleine moleculen, zei polariteit enδ+-Xδ- Het is vrij relatief.
Dit is geen probleem met de moleculen gevormd tussen niet -metalen elementen; Maar wanneer overgangs- of metalloïde metalen deelnemen, is er niet langer alleen gesproken over een polaire covalente binding, maar van een covalente binding met een bepaald ionisch karakter; en in het geval van overgangsmetalen, van een covalente coördinatiekink gezien de aard van hetzelfde.
Polaire covalente bindingsvoorbeelden
CO
De covalente binding tussen koolstof en zuurstof is polair, omdat de eerste minder elektronegatief is (χC = 2.55) dat de tweede (χOF = 3,44). Daarom, wanneer we de links c-o zien, c = o o c-o-, We zullen weten dat het polaire links zijn.
H-X
Waterstofhalogeniden, HX, zijn ideale voorbeelden om de polaire binding in hun diatomeeënmoleculen te begrijpen. Met waterstofelektronegativiteit (χH = 2.2), kunnen we schatten hoe polair deze halogenuros zijn:
-Hf (h-f), χF (3.98) - χH (2,2) = 1,78
-HCl (H-Cl), χKlet (3,16) - χH (2,2) = 0,96
-HBR (H-BR), χBR (2.96) - χH (2,2) = 0,76
-Hallo (H-I), χJe (2.66) - χH (2,2) = 0,46
Merk op dat volgens deze berekeningen de H-F-link de meest polaire van allemaal is. Wat nu zijn ionische karakter is uitgedrukt als een percentage, is een ander onderwerp. Dit resultaat is niet verrassend omdat fluor het meest elektronegatieve element van allemaal is.
Wanneer elektronegativiteit afdaalt van chloor naar jodium, worden de H-CL-, H-BR- en H-I-links minder polair. De H-I-link moet apolair zijn, maar in werkelijkheid is het polair en ook zeer "bros"; Breekt gemakkelijk.
Kan u van dienst zijn: Mercury Hydroxide: structuur, eigenschappen, gebruik, risico'sOH
De Polar O-H-link is misschien wel de belangrijkste van allemaal: dankzij hem is er leven, omdat hij samenwerkt met het dipoolmoment van het water. Als we het verschil schatten tussen de elektronegativiteiten van zuurstof en hydrogenen, zullen we hebben:
χOF (3.44) - χH (2,2) = 1,24
Het watermolecuul, h echter2Of het heeft twee van deze links, h-o-h. Dit, en de hoekige geometrie van het molecuul en zijn asymmetrie, maken het een zeer polaire verbinding.
N-H
De N-H-link is aanwezig in de aminogroepen van eiwitten. Dezelfde berekening herhalen die we hebben:
χN (3.04) - χH (2,2) = 0,84
Dit weerspiegelt dat de N-H-link minder polair is dan O-H (1,24) en F-H (1,78).
Lelijk
De Fe-O-link is belangrijk omdat hun oxiden worden gevonden in ijzermineralen. Laten we kijken of het meer polair is dan H-O:
χOF (3.44) - χVertrouwen (1.83) = 1.61
Vanaf hier wordt het terecht verondersteld dat de Fe-O-link meer polair is dan de H-O-link (1,24); of wat hetzelfde is als zeggen: Fe-o heeft een groter ionisch karakter dan H-o.
Deze berekeningen dienen om de mate van polariteit tussen verschillende links te verschijnen; Maar ze zijn niet genoeg om te regeren of een verbinding ionisch, covalent of zijn ionische karakter is.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Laura Nappi. (2019). Polaire en niet -polaire covalente bindingen: definities en voorbeeld. Studie. Hersteld van: studie.com
- Helmestine, Anne Marie, pH.D. (18 september 2019). Definitie en voorbeeld van polaire bindingen (polaire covalente binding). Hersteld van: Thoughtco.com
- Elsevier B.V.(2019). Polaire covalente binding. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Wikipedia. (2019). Chemische polariteit. Opgehaald uit: in.Wikipedia.borg
- Anoniem. (5 juni 2019). Eigenschappen van polaire covalente bindingen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg

