Niet -polaire covalente binding
- 3103
- 651
- Aaron Okuneva
We leggen uit wat een niet -polaire covalente binding is, de kenmerken en verschillende voorbeelden
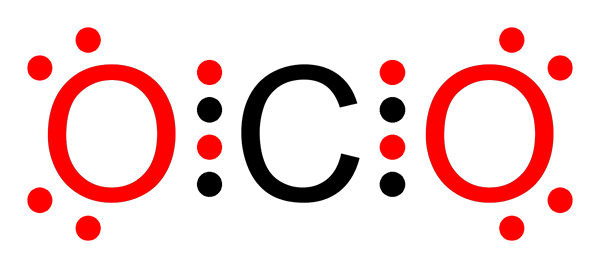
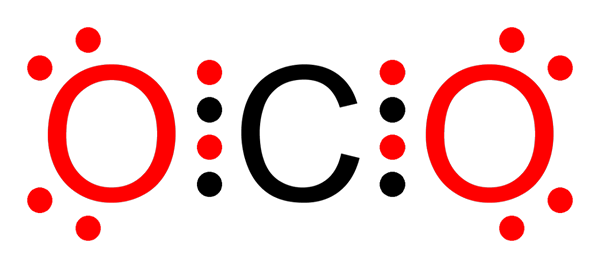 Niet -polaire covalente binding van koolstofdioxide
Niet -polaire covalente binding van koolstofdioxide Wat is een niet -polaire covalente binding?
A niet -polaire covalente binding, Ook wel pure of apolaire covalente binding genoemd, het is de unie van twee atomen die een of meer elektronenparen gelijk hebben. Met andere woorden.
Dit type link ligt tussen twee gelijke atomen (van hetzelfde element) of tussen twee verschillende atomen, maar die zeer vergelijkbare elektronegativiteiten hebben.
Er zijn drie soorten chemische links die de atomen bij elkaar houden. Dit zijn: de ionische binding, de covalente binding en de metalen link. Deze links verschillen volgens hoe elektronen worden verdeeld over atomen.
In het geval van covalente bindingen delen de twee atomen de valentie -elektronen, wat betekent dat deze elektronen, in plaats van om een atoom te draaien, om de twee draaien. Dit is echter niet altijd billijk, omdat elektronen liever meer tijd doorbrengen in de buurt van het meest elektronegatieve atoom, wat aanleiding geeft tot een polaire covalente binding.
In het geval van niet -polaire covalente bindingen gebeurt dit niet, omdat beide atomen dezelfde elektronegativiteit hebben of zeer vergelijkbare elektronegativiteiten.
Kenmerken van de niet -polaire covalente link
1. Ze worden gevormd tussen atomen met gelijke of zeer vergelijkbare elektronegativiteiten
Het zijn covalente links die zich vormen tussen gelijke atomen of die zeer vergelijkbare elektronegativiteiten hebben. Over het algemeen wordt een covalente binding beschouwd als niet polair als het verschil van elektronegativiteiten kleiner is dan of gelijk is aan 0,4.
Kan u van dienst zijn: Sucidinezuur: structuur, eigenschappen, verkrijgen, gebruik2. Ze kunnen eenvoudig, dubbel of drievoudig zijn
Afhankelijk van het aantal paren elektronen dat beide atomen delen, kunnen niet -polaire of apolaire covalente bindingen eenvoudig, dubbel of drievoudig zijn.
Wanneer de binding wordt gevormd door een enkel paar elektronen, wordt deze een eenvoudige link genoemd, wanneer twee elektronenparen worden gedeeld, wordt deze een dubbele binding genoemd en als drie elektronenparen worden gedeeld, wordt deze Triple Link genoemd.
3. Ze betreffen bijna altijd niet -metalen
Metalen zijn elementen met zeer lage elektronegativiteiten die metaalverbindingen naar elkaar vormen. Wanneer ze worden gekoppeld aan niet -metalen, vormen ze altijd ionische bindingen of polaire links. Om deze reden worden niet -polaire covalente bindingen alleen gevormd tussen niet -metalen elementen zoals waterstof en koolstof.
4. Ze geven aanleiding tot apolaire verbindingen
Een verbinding die alleen niet -polaire covalente bindingen heeft, zal worden gevormd door apolaire moleculen. Dit soort verbindingen worden gekenmerkt door lage kook- en fusiepunten te hebben in vergelijking met metalen en ionische verbindingen (sommige zijn zelfs gassen bij kamertemperatuur), ze zijn onoplosbaar in water en zijn slechte geleiders van warmte en elektriciteit.
5. Ze kunnen vaste, vloeibare of gasvormige verbindingen vormen bij kamertemperatuur
Verbindingen met niet -polaire covalente bindingen kunnen lage maar zeer gevarieerde kook- en fusiepunten hebben.
Daarom zijn sommigen van hen gassen bij kamertemperatuur (zoals waterstof, h2, en stikstof, n2), anderen zijn vloeistoffen (zoals bromo, br2), terwijl anderen solide zijn (zoals naftaleen, c10H8)).
6. Ze hebben relatief lage linkergieën.
In vergelijking met ionische links zijn niet -polaire covalente bindingen gemakkelijker te breken, omdat ze een lagere linkergie hebben. Dit betekent dat u minder energie moet gebruiken om een niet -polaire covalente binding te verbreken dan een ionische binding.
Kan u van dienst zijn: stoichiometrische wettenVoorbeelden van niet -polaire covalente links
H-H-link in het waterstofmolecuul (h2))
In het waterstofmolecuul, h2, Twee waterstofatomen delen hun enige valentie -elektronen om een eenvoudige covalente binding te vormen.
 Waterstofmolecuul
Waterstofmolecuul Omdat beide atomen hetzelfde zijn, zal het verschil in elektronegativiteiten tussen de twee nul zijn, dus deze link is een niet -polaire covalente binding.
F-f link in het fluormolecuul (f2))
Dit voorbeeld benadrukt het feit dat het niet uitmaakt van de elektronegativiteit van een atoom, maar het verschil in elektronegativiteiten van de twee atomen die een link vormen om te weten of de link covalent is, niet polair of niet.
 Fluormolecuul
Fluormolecuul Fluor is het meest elektronegatieve element van het periodiek systeem, dus het heeft de neiging om zijn elektronen uit de andere elementen te verwijderen om polaire of ionische bindingen te vormen.
Wanneer echter een fluorideatoom is gekoppeld aan een andere gelijk aan hem, kan geen van beide elektronen uit de ander verwijderen (er is geen verschil in elektronegativiteit), dus ze hebben geen andere keuze dan ze billijk te delen en dus, dus vorm, vorm niet -polaire covalente link.
O-o links in het ozonmolecuul (of3))
Zoals in het geval van fluormolecuul, is zuurstof ook een zeer elektronegatief element. Door links te vormen met andere zuurstofatomen, vormt het echter niet -polaire covalente bindingen. Dat is het geval van het ozonmolecuul.
 Ozonmolecuul
Ozonmolecuul In dit geval is het centrale zuurstofatoom gekoppeld aan twee andere zuurstofatomen door middel van niet -polaire of apolaire covalente bindingen.
Kan u van dienst zijn: magnesiumoxide: structuur, eigenschappen, nomenclatuur, gebruikN-N-link in het stikstofmolecuul (n2))
Het stikstofmolecuul bevat een niet -polaire covalente binding, waarbij elk stikstofatoom zijn drie valentie -elektronen deelt die met de andere is verdwenen.
 Stikstofmolecuul
Stikstofmolecuul Om deze reden delen beide atomen in totaal drie paar elektronen, waardoor een drievoudige covalente binding wordt gevormd.
C-H-koppelingen in het methaanmolecuul (CH4))
Methaan is een voorbeeld van een niet -polaire covalente binding gevormd tussen atomen van verschillende elementen, in dit geval koolstof en waterstof.
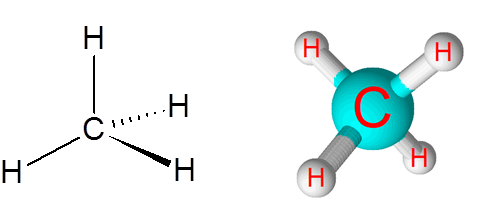 Methaanmolecuul
Methaanmolecuul Het verschil in elektronegativiteit tussen de twee elementen is 0,4 die deze grens plaatst alleen tussen de niet -polaire en polaire bindingen.
Link c = c in het ethyleenmolecuul (c2H4))
Het ethyleenmolecuul, ook wel Eteno genoemd, heeft in totaal vijf links. Vier C-H-links en een dubbele binding C = C. In beide gevallen komen de links overeen met niet -polaire of apolaire covalente bindingen.
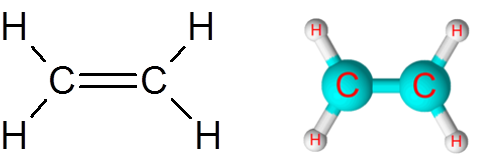 Ethyleenmolecuul
Ethyleenmolecuul
- « 6 dansen en dansen die typerend zijn voor Quintana Roo
- De 9 dansen en typische dansen van Michoacán beroemder »

