Dubbele covalente binding

- 3229
- 264
- Nathan Wiegand
We leggen uit wat een dubbele covalente binding is, de kenmerken ervan en geven verschillende voorbeelden
 Eteno of ethyleenmolecuul. Het is een typisch voorbeeld van een dubbele covalente binding tussen twee koolstofatomen
Eteno of ethyleenmolecuul. Het is een typisch voorbeeld van een dubbele covalente binding tussen twee koolstofatomen Wat is een dubbele covalente binding?
De dubbele covalente bindingen Het zijn chemische links waarin twee atomen twee paar elektronen delen. Met andere woorden, het zijn covalente bindingen gevormd door in totaal vier valentie -elektronen die rond twee atomen draaien.
Dubbele links zijn heel gebruikelijk in organische verbindingen. Alle alkenen hebben bijvoorbeeld een dubbele koolstof-koolstofbinding. Veel andere functionele groepen zoals aldehyden, ketonen, carbonzuren en amiden hebben ook dubbele covalente bindingen tussen koolstof en zuurstof. Anderen, zoals imine hebben dubbele covalente bindingen C = n.
Dubbele links hebben veel kenmerken die ze onderscheiden van andere soorten covalente bindingen zoals eenvoudige links en drievoudige links. Ze verschillen in de vorm van de moleculen die ze bevatten, in de lengte en linkkracht en andere kenmerken die verband houden met hun chemische eigenschappen.
Dubbele covalente linkkarakteristieken
Ze worden gevormd door 4 elektronen
De reden waarom dubbele bindingen zijn omdat ze dubbele elektronen bevatten van een eenvoudige covalente binding, die wordt gevormd wanneer twee atomen twee valentie -elektronen delen. Dit betekent dat elke dubbele binding 4 elektronen bevat.
Ze worden gevormd door een sigma -link (σ) en een pi (π) link
Van de 4 elektronen die een dubbele binding vormen, gaan er 2 en komen tussen het ene atoom en het andere, door het midden van de twee. Dit paar elektronen worden sigma -elektronen genoemd, omdat ze een sigma -binding vormen (σ).
Het andere paar elektronen zweeft boven en onder de twee atomen die een soort sandwich maken. Deze elektronen worden PI -elektronen genoemd en vormen een pi (π) link.
Kan u van dienst zijn: chloorbenzeen (c6h5cl)Samen vormen de Sigma -link en de PI -link de dubbele covalente binding.
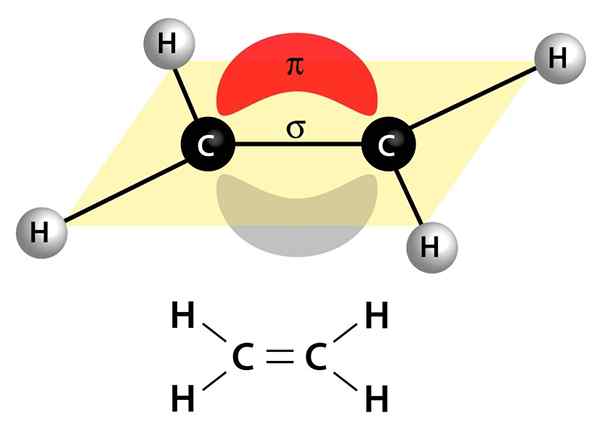 Deze afbeelding toont de twee links die een dubbele binding vormen: de PI -link die verschijnt als een rode en grijze wolk die zich boven en onder het molecuul bevindt, en de Sigma -link die de lijn is die beide kernen via het midden verbindt
Deze afbeelding toont de twee links die een dubbele binding vormen: de PI -link die verschijnt als een rode en grijze wolk die zich boven en onder het molecuul bevindt, en de Sigma -link die de lijn is die beide kernen via het midden verbindt Ze kunnen polair of apolair zijn
Afhankelijk van de elektronegativiteit van de atomen die verenigd zijn door middel van een dubbele covalente binding, kan het polair of apolair zijn.
Bijvoorbeeld een dubbele covalente binding C = C Het zal een apolaire link zijn, omdat beide atomen hetzelfde zijn en dezelfde elektronegativiteit hebben. In plaats daarvan een dubbele covalente binding C = O Het zal polair zijn, omdat zuurstof veel elektronegatief is dan koolstof.
Ze zijn sterker dan eenvoudige links
Het verbreken van een dubbele binding is moeilijker dan het verbreken van een eenvoudige link tussen dezelfde twee atomen. Dit komt omdat, om een dubbele binding te verbreken, zowel een Sigma -link (die gelijk is aan de eenvoudige link) en een PI -link moet worden verbroken. Omdat twee links moeten worden verbroken in plaats van één, is de dubbele binding sterker dan de eenvoudige.
Ze zijn zwakker dan drievoudige links
In vergelijking met de drievoudige link is de dubbele binding zwakker en gemakkelijker te breken. De reden is hetzelfde als voorheen, alleen dat, in dit geval, de dubbele obligatie minder links heeft dan breken in vergelijking met de drievoudige link.
Ze zijn korter dan eenvoudige links
Omdat ze sterkere links zijn dan eenvoudige links, kunnen dubbele bindingen gekoppelde atomen dichterbij brengen dan eenvoudige links dan eenvoudige links. Om deze reden, als een dubbele C = C-link wordt vergeleken met een eenvoudige C-C-link, is de eerste altijd korter dan de tweede.
Kan u van dienst zijn: natriumthiosulfaat (Na2S2O3)Ze zijn langer dan drievoudige links
Nogmaals, wanneer de drievoudige link sterker is dan de dubbele link, is de drievoudige link korter. Dit houdt in dat dubbele covalente bindingen langer zijn dan drievoudig.
Het zijn rigide links.
Eenvoudige covalente bindingen zijn vrij flexibel en kunnen ook roteren. Aan de andere kant zijn de dubbele bindingen rigide, ze zijn niet flexibel en kunnen niet worden gedraaid, omdat de hierboven genoemde PI -link zou worden verbroken.
Ze vertegenwoordigen onverzadiging
Een molecuul met een dubbele binding zal twee minder gekoppelde waterstofatomen hebben dan het had kunnen. Om deze reden wordt gezegd dat een dubbele binding een onverzadiging vertegenwoordigt (elke onverzadiging komt overeen met 2 hydrogenen).
Ze vormen platte driehoekige moleculen
Een koolstofatoom dat een dubbele covalente binding en twee andere eenvoudige bindingen vormt, vormt altijd een plat molecuul waarin de drie bindingen naar de uiteinden van een driehoek wijzen. Deze vorm wordt platte trigonale geometrie genoemd.
Voorbeelden van dubbele covalente bindingen
Link C = C in ethyleen
Ethyleen is een van de eenvoudigste voorbeelden van een dubbele covalente binding, in dit geval tussen twee koolstofatomen.
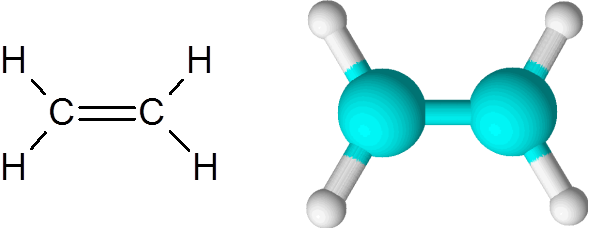 Ethyleenmolecuul
Ethyleenmolecuul Het molecuul is volledig plat en het is niet mogelijk om de link in elke richting te roteren. Deze dubbele binding is volledig apolair, omdat hij twee gelijke atomen verbindt.
Link c = o in aceton
Alle ketonen bevatten een carbonylgroep, die bestaan uit een koolstofatoom en een zuurstofatoom verenigd door middel van een dubbele covalente binding.
Kan u van dienst zijn: wat is chemische kinetiek?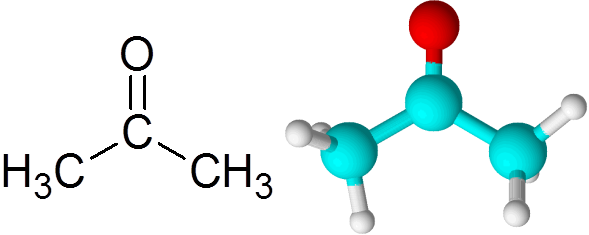 Acetonmolecuul
Acetonmolecuul Elk atoom draagt twee ontbrekende elektronen bij om zowel de Pi- als de Sigma -link te vormen die de dubbele binding vormen. De meeste chemische reacties die op ketonen opkomen, zijn te wijten aan de dubbele binding c = o.
De link o = of in het ozonmolecuul (of3))
In dit geval is het centrale zuurstofatoom gekoppeld aan twee andere zuurstofatomen. Een van de twee bindingen wordt gevormd door 4 elektronen, dus het komt overeen met een dubbele covalente binding. De drie atomen en een paar elektronen zonder te delen die het centrale zuurstofatoom hebben, bevinden zich allemaal in hetzelfde vlak van het scherm dat naar de hoeken van een driehoek wijst.
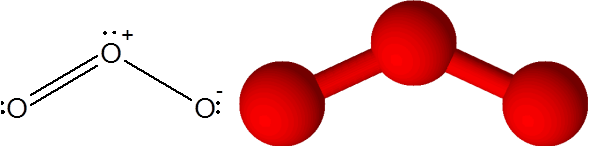 Ozonmolecuul
Ozonmolecuul Ozon heeft de eigenaardigheid dat de dubbele binding kan "springen" van een van de terminale zuurstof naar de andere. In feite doet hij het heel snel door een proces dat resonantie wordt genoemd.
C = c links in de butadieno (c4H6))
Butadieno is een voorbeeld van een organische verbinding met twee dubbele covalente bindingen C = C.
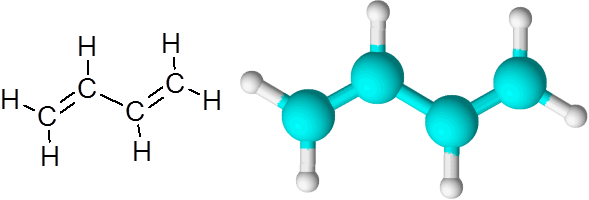 1.3-butadieenmolecuul
1.3-butadieenmolecuul Wanneer de dubbele bindingen op deze manier zijn, gescheiden door een enkele eenvoudige link, wordt gezegd dat ze geconjugeerde dubbele links zijn.

